См. Документы Министерства здравоохранения Российской Федерации
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПИСЬМО
от 5 марта 2019 г. N 15-4/И/2-1913
Министерство здравоохранения Российской Федерации направляет для использования в работе клинические рекомендации (протокол лечения) "Женское бесплодие (современные подходы к диагностике и лечению)", разработанные в соответствии со статьей 76 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", взамен одноименных клинических рекомендаций, направленных в субъекты Российской Федерации письмом Министерства здравоохранения Российской Федерации от 15 февраля 2019 г. N 15-4/И/2-1218.
Т.В.ЯКОВЛЕВА
Приложение
Утверждаю
Президент Российского общества
акушеров-гинекологов
академик РАН
В.Н.СЕРОВ
28 декабря 2018 г.
Президент Российской ассоциации
репродукции человека
профессор
В.С.КОРСАК
21 декабря 2018 г.
Согласовано
Главный внештатный специалист
Минздрава России
по акушерству и гинекологии
академик РАН
Т.В.АДАМЯН
28 декабря 2018 г.
ЖЕНСКОЕ БЕСПЛОДИЕ
(СОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ И ЛЕЧЕНИЮ)
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ (ПРОТОКОЛ ЛЕЧЕНИЯ)
Ключевые слова
- Бесплодие
- Бесплодие, комбинированное с мужскими факторами
- Внутриматочная инсеминация
- Вспомогательные репродуктивные технологии
- Другие формы бесплодия
- Женское бесплодие маточного происхождения
- Женское бесплодие неуточненное
- Женское бесплодие, связанное с отсутствием овуляции
- Женское бесплодие трубного происхождения
- Женское бесплодие цервикального происхождения
- Осложнения вспомогательных репродуктивных технологий
- Синдром гиперстимуляции яичников
- Экстракорпоральное оплодотворение
Список сокращений
аГнРГ - агонисты гонадотропин-рилизинг гормона
АМГ - антимюллеров гормон
антГнРГ - антагонисты гонадотропин-рилизинг гормона
ВЗОМТ - воспалительные заболевания органов малого таза
ВИЧ - вирус иммунодефицита человека
ВМИ - внутриматочная инсеминация
ВМС - внутриматочная спираль
ВРТ - вспомогательные репродуктивные технологии
ГСГ - гистеросальпингография
ГТ - гонадотропин
ДЭА-С - дегидроэпиандростерона сульфата
Е2 - эстрадиол
ИМТ - индекс массы тела
ИКСИ - инъекция сперматозоида в цитоплазму ооцита
ИППП - инфекции, передаваемые половым путем
КАФ - количество антральных фолликулов
К - кортизол
ЛГ - лютеинизирующий гормон
MAR-test - смешанная антиглобулиновая реакция
ОКК - ооцит-кумулюсный комплекс
ОС - овариальная стимуляция
П - прогестерон
ПГТ - преимплантационное генетическое тестирование
ПГТ-А - преимплантационное генетическое тестирование эмбрионов на анеуплоидии
ПГТ-М - преимплантационное генетическое тестирование эмбрионов на моногенные заболевания
ПНЯ - преждевременная недостаточность яичников
ПРЛ - пролактин
ПЦР - полимеразная цепная реакция
ПЭ - перенос эмбриона(ов) в полость матки
СГЯ - синдром гиперстимуляции яичников
СПКЯ - синдром поликистозных яичников
Т - тестостерон
ТВП - трансвагинальная пункция яичников
ТТГ - тиреотропный гормон
Т4св - свободная фракция тироксина;
Т3св - свободная фракция трийодтиронина
УЗИ - ультразвуковое исследование
ФГА - функциональная гипоталамическая аменорея
ФСГ - фолликулостимулирующий гормон
ХГЧ - хорионический гонадотропин человека
ЭКО - экстракорпоральное оплодотворение
Термины и определения
Бесплодие - заболевание, характеризующееся невозможностью достичь клинической беременности после 12 месяцев регулярной половой жизни без контрацепции вследствие нарушения способности субъекта к репродукции, либо индивидуальной, либо совместно с его/ее партнером. Вмешательства по поводу бесплодия могут быть начаты и ранее 1 года, основываясь на данных медицинского, сексуального и репродуктивного анамнеза, возраста, данных физикального обследования и диагностических тестов.
Биохимическая беременность - беременность, диагностированная только путем определения бета-ХГЧ в сыворотке крови или в моче.
Внутриматочная инсеминация - процедура, во время которой обработанная в лабораторных условиях сперма вводится в полость матки с целью достижения беременности.
Вспомогательные репродуктивные технологии (ВРТ) - все манипуляции in vitro с ооцитами, сперматозоидами или эмбрионами человека с целью репродукции. Эти вмешательства включают в себя: ЭКО, ПЭ, ИКСИ, биопсию эмбриона, ПГТ, вспомогательный хетчинг, криоконсервацию гамет и эмбрионов, донорство спермы, ооцитов и эмбрионов, циклы с переносом эмбрионов женщине, вынашивающей беременность.
Вспомогательный хетчинг - микроманипуляция в рамках ВРТ, во время которой блестящую оболочку эмбриона перфорируют химически, механически, с помощью лазера или ферментативно.
Вторичное бесплодие - состояние, при котором у женщины в прошлом были беременности, однако в течение года регулярной половой жизни без предохранения зачатие более не происходит.
Женское бесплодие - неспособность женщины к зачатию в течение 1 года регулярной половой жизни без контрацепции.
Индукция овуляции - фармакологическая терапия у женщин с ановуляцией или олигоовуляцией с целью формирования нормальных овуляторных циклов.
Клиническая беременность - беременность, диагностированная путем визуализации при ультразвуковом исследовании одного или более плодных яиц, или наличия достоверных клинических признаков беременности. Кроме маточной беременности, термин включает клинически подтвержденную эктопическую беременность.
Криоконсервация - процесс медленного замораживания или витрификации для сохранения биологического материала (например, гамет, зигот, эмбрионов на стадии дробления, бластоцист или ткани гонад) при экстремально низких температурах.
Мужское бесплодие - неспособность половых клеток зрелого мужского организма к оплодотворению.
Овариальная стимуляция/стимуляция яичников (ОС) - фармакологическая терапия с целью индуцировать развитие фолликулов в яичниках.
Первичное бесплодие - состояние, при котором у женщины не было ни одной беременности, несмотря на регулярную половую жизнь в течение года без применения контрацептивных средств.
Перенос эмбриона (ПЭ) - введение в полость матки эмбриона на любой стадии его развития с 1 по 7 день после экстракорпального оплодотворения (ЭКО/ИКСИ), или размороженного эмбриона после криоконсервации.
Преимплантационное генетическое тестирование (ПГТ) - тест, выполняемый для анализа ДНК ооцитов (полярных телец) или эмбрионов (на стадии дробления или бластоцисты) для HLA-типирования или для определения генетических аномалий. Он включает: ПГТ на анеуплоидии (ПГТ-А); ПГТ на моногенные заболевания/дефекты одного гена (ПГТ-М); и ПГТ на хромосомные структурные перестройки (ПГТ-СП).
Синдром гиперстимуляции яичников - чрезмерный системный ответ на стимуляцию яичников, характеризующийся широким спектром клинических и лабораторных проявлений. Может быть классифицирован как легкий, умеренный или тяжелый, в соответствии со степенью напряженности асцита, увеличения яичников и дыхательных, гемодинамических и метаболических осложнений.
Частота наступления клинической беременности - количество клинических беременностей на 100 начатых циклов, циклов с пункцией фолликулов или циклов с переносом эмбриона. При предоставлении данных о частоте наступления клинической беременности необходимо указывать, относительно каких циклов она рассчитана (на начатые циклы, на циклы с пункцией фолликулов или на циклы с переносом эмбриона). Частота родов живым ребенком - количество родов, которые закончились рождением хотя бы одного живого ребенка в расчете на 100 начатых циклов, циклов с пункцией фолликулов или циклов с переносом эмбриона. При представлении частоты родов необходимо указывать, относительно каких циклов она рассчитана (на начатые циклы, на циклы с пункцией фолликулов или на циклы с переносом эмбриона).
Экстракорпоральное оплодотворение (ЭКО) - последовательность манипуляций, включающая экстракорпоральное оплодотворение ооцитов. Оно включает традиционную инсеминацию in vitro и ИКСИ.
1. Факторы, влияющие на наступление беременности
Определение бесплодия
Бесплодие - заболевание, характеризующееся невозможностью достичь клинической беременности в течение 12 месяцев регулярной половой жизни без контрацепции вследствие нарушения способности субъекта к репродукции, либо индивидуальной, либо совместно с его/ее партнером. Вмешательства по поводу бесплодия могут быть начаты и ранее 1 года, основываясь на данных медицинского, сексуального и репродуктивного анамнеза, возраста, данных физикального обследования и диагностических тестов [1].
Вероятность зачатия
Вероятность зачатия остается относительно стабильной от цикла к циклу у конкретных индивидуумов, но в первые 3 месяца незащищенного полового акта является самой высокой и постепенно снижается. В течение первых 6 месяцев беременность наступает примерно у 80% супружеских пар [2].
Способность к зачатию снижается с возрастом как у мужчин, так и у женщин, но у женщин влияние возраста более выражено. Способность к зачатию снижается почти в 2 раза у женщин в возрасте после 30 лет по сравнению с женщинами 20 лет и значительно уменьшается после 35 лет [3]. Параметры спермы также ухудшаются после 35 лет, но способность к зачатию, вероятно, остается высокой до 50 лет [4].
Комментарии:
время, необходимое для наступления беременности, увеличивается с возрастом;
для женщин старше 35 лет консультации с акушером-гинекологом для обследования и лечения следует начинать после 6 месяцев безуспешных попыток естественного зачатия.
Частота половых актов
Вероятность зачатия максимальна при частоте половых актов 3 - 4 раза в неделю. У мужчин с нормальным качеством спермы, ее концентрация и подвижность остаются нормальными даже при ежедневной эякуляции [5]. Интервалы воздержания более 5 дней могут отрицательно влиять на количество сперматозоидов [6].
Комментарии:
половые акты каждые 1 - 2 дня позволяют добиться самых высоких показателей зачатия, однако менее частые половые акты (каждые 2 - 3 дня) дают почти эквивалентные результаты;
нет доказательств того, что положение тела во время полового акта и после него влияет на вероятность зачатия.
Оптимальное время для зачатия
Наиболее оптимальное время для зачатия - это день овуляции и 2 - 3 дня до овуляции. День овуляции можно определить по мочевому тесту, который основан на определении пика лютеинизирующего гормона (ЛГ) и становится положительным за 1 - 2 дня до овуляции [7].
Комментарии:
оптимальное время зачатия соответствует 6-дневному интервалу, включая день овуляции и коррелирует с объемом и характером цервикальной слизи;
определение оптимального интервала зачатия наиболее актуально для супружеских пар с редкими половыми актами.
Интимные лубриканты
Использование интимных лубрикантов на водной, масляной или силиконовой основе ухудшают выживаемость сперматозоидов и снижают вероятность зачатия. Использование интимных лубрикантов на основе гидроксиэтилцеллюлозы в меньшей степени влияют на качество спермы [8].
Образ жизни и питание
Здоровый образ жизни, правильное питание, индекс массы тела (ИМТ) от 19 до 30 кг/м2 увеличивают вероятность зачатия.
Время до зачатия увеличивается в 2 раза при ИМТ > 35 кг/м2 и в 4 раза - при ИМТ < 18 кг/м2 [9].
Курение оказывает существенное влияние на возможность зачатия, увеличивая шансы бесплодия в 1,6 раз (ОШ = 1,60 95% ДИ = 1,34 - 1,91) [10], [11].
Потребление алкоголя более 20 г этанола в день увеличивает риск бесплодия на 60% [12].
Данные об отрицательном влиянии курения и употребления алкоголя на параметры спермы противоречивы [13]. Однако поскольку курение отрицательно сказывается на общем здоровье и благополучии, рекомендуется, чтобы мужчины также воздерживались от курения перед планированием зачатия [14].
Высокий уровень потребления кофеина (500 мг или более 5 чашек в день) снижает шансы наступления беременности в 1,45 раз (ОШ = 1,45, 95% ДИ = 1,03 - 2,04). Во время беременности потребление кофеина более 200 - 300 мг (2 - 3 чашки в день) увеличивает риск самопроизвольных выкидышей, но не влияет на риск врожденных аномалий плода [15].
Посещение сауны не снижает шансы зачатия у женщины и безопасно при неосложненной беременности [16]. Мужчинам рекомендуется уменьшить тепловые воздействия на яички [17].
2. Женское бесплодие
В соответствии с рекомендациями ВОЗ и требованиями Министерства здравоохранения РФ, МКБ-10 является единственным нормативным документом формулировки и учета диагнозов в системе здравоохранения на территории страны.
N97. Женское бесплодие (включены: неспособность забеременеть, стерильность женская); (исключены: относительное бесплодие).
N97.0. Женское бесплодие, связанное с отсутствием овуляции.
N97.1. Женское бесплодие трубного происхождения (связанное с врожденной аномалией маточных труб или трубной непроходимостью).
N97.2. Женское бесплодие маточного происхождения (связанное с врожденной аномалией матки, дефектами имплантации яйцеклетки).
N97.3. Женское бесплодие цервикального происхождения.
N97.4. Женское бесплодие, связанное с мужскими факторами.
N97.8. Другие формы женского бесплодия.
N97.9 Женское бесплодие неуточненное.
Мужское бесплодие закодировано единственным шифром N46 - Мужское бесплодие (азооспермия, олигозооспермия).
Этиология и патогенез
Бесплодие возникает вследствие различных патологических процессов в репродуктивной системе женщин и мужчин. Этиологические и патогенетические факторы бесплодия целесообразно рассматривать в контексте его различных форм.
Эпидемиология
В России частота бесплодных браков колеблется от 17,2% до 24% в различных регионах [18], [19], [20], [21].
Классификация
Женское бесплодие - неспособность к зачатию в течение года регулярной половой жизни без контрацепции.
Мужское бесплодие - неспособность половых клеток зрелого мужского организма к оплодотворению.
Сочетанное женское бесплодие - сочетание нескольких причин у женщины, сочетанное мужское бесплодие - сочетание нескольких причин у мужчины, комбинированное бесплодие - комбинация женских и мужских причин бесплодия у супругов/партнеров.
2.1 Диагностика
2.1.1. Обследование женщины
Оценка жалоб и анамнеза включает данные о:
- длительности бесплодия;
- общем самочувствии женщины (головные боли, слабость, раздражительность, нарушения сна);
- наличии болей (их локализации, характера, зависимости от фазы менструального цикла);
- семейном анамнезе;
- перенесенных соматических и гинекологических заболеваниях;
- перенесенных инфекциях, передаваемых половым путем (ИППП), и хронических воспалительных заболеваниях органов малого таза (ВЗОМТ);
- наличии аллергических реакций;
- вредных привычках (курении, потреблении алкоголя, психотропных препаратов, наркотиков);
- воздействии вредных экологических факторов, в том числе профессиональных вредностей;
- результатах предшествующего лечения, в том, числе хирургического, а также показаниях к их проведению;
- менструальном цикле: возрасте менархе, регулярности, продолжительности, болезненности менструаций;
- предыдущих методах контрацепции;
- половой жизни: в каком возрасте началась, какой брак по счету, его продолжительность, особенности сексуальной жизни (либидо, оргазм, частота половых контактов, болезненность полового акта - диспареуния), количестве половых партнеров;
- детородной функции: количестве предыдущих беременностей, их течения, исхода, осложнениях в родах и в послеродовом периоде;
- характере питания;
- приеме лекарственных средств.
Общий осмотр включает определение:
- типа телосложения (нормостенический, астенический, гиперстенический);
- типа распределения подкожной жировой клетчатки: верхний тип - отложение жира на плечах, грудной клетке, животе (мужской или андроидный); нижний тип - отложение жира на бедрах, ягодицах (женский или гиноидный);
- состояния кожных покровов и видимых слизистых (акне, себорея, полосы растяжения (стрии), наличие гиперпигментаций трущихся поверхностей (негроидный акантоз);
- индекса массы тела (ИМТ), который рассчитывается по формуле: [масса тела (кг) / рост (м)2];
- степени и типа оволосения;
- степени развития и состояния молочных желез путем осмотра и пальпации для определения узловых образований и наличия галактореи [22].
Гинекологический осмотр (бимануальное влагалищное исследование и исследование с помощью влагалищных зеркал) включает определение:
- особенностей развития наружных половых органов;
- состояния влагалища (болезненности сводов, характера и количества влагалищных выделений);
- состояния шейки матки (цвета, характера слизистой, наличия рубцовых изменений, определение цервикального числа);
- размера и формы матки, ее подвижности, плотности, гладкости, болезненности;
- состояния придатков матки (размеров яичников, наличия тубоовариальных образований, подвижности, болезненности придатков матки, наличия спаек);
- состояния крестцово-маточных связок, их уплотнения и болезненности [22].
Уровень доказательности 1A.
Лабораторная диагностика
Инфекционный скрининг включает:
- Микроскопическое исследование мазка из цервикального канала и влагалища (срок годности исследования - 1 месяц).
- Молекулярно-биологическое исследование соскоба из цервикального канала на выявление генетического материала Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis [23] (срок годности исследования - 1 год).
Оценка овуляции
Оценка овуляторной функции может быть определена одним их ниже указаннных методов.
- Определение уровня прогестерона в крови (за 7 дней до менструации) (срок годности исследования - 1 год).
Комментарий:
уровень прогестерона > 10 нг/мл может подтверждать факт произошедшей овуляции, хотя и не является достоверным признаком, поскольку секреция прогестерона имеет циклический характер и может изменяться до 7 раз с интервалом в 7 часов [24].
- Проведение мочевого теста на овуляцию.
Комментарии:
коммерческие мочевые наборы идентифицируют пик ЛГ за 1 - 2 дня до овуляции и помогают определить период времени с максимальной вероятностью зачатия, соответствующий дню положительного теста и последующим двум дням;
результаты теста коррелируют с пиком ЛГ в сыворотке крови;
точность результатов может различаться между различными коммерческими тестами с получением ложноположительных и ложноотрицательных результатов [25].
- Ультразвуковой мониторинг овуляции, который позволяет оценить рост и созревание фолликулов, произошедшую овуляцию, формирование желтого тела [26].
Комментарий:
этот подход может быть рекомендован в тех случаях, когда более простые методы не дают необходимую информацию, а также в циклах овариальной стимуляции.
- Биопсия эндометрия с гистологическим исследованием биоптата не должна использоваться в качестве рутинной оценки овуляции и секреторной трансформации эндометрия.
Комментарии:
гистологическая оценка состояния эндометрия показана при подозрении на патологические процессы эндометрия (хронический эндометрит, полип, гиперплазия) [27].
Оценка овариального резерва
Овариальный резерв - это число фолликулов в яичниках, определяющее количество и качество ооцитов. Оценка овариального резерва является обязательной у всех женщин, обращающихся по поводу бесплодия, и определяется с помощью ниже указанных методов.
- Определение уровня антимюллерова гормона (АМГ) в крови (срок годности исследования - 1 год).
Комментарии:
концентрация АМГ в крови не зависит от уровня гонадотропинов и является относительно постоянной величиной как у фертильных женщин, так и у женщин с бесплодием, поэтому его можно определять в любой день цикла;
уровень АМГ < 1,2 нг/мл ассоциирован с высокой вероятностью "бедного" ответа яичников на стимуляцию, низким качеством эмбрионов и низкими шансами наступления беременности в программах вспомогательных репродуктивных технологий (ВРТ);
уровень АМГ > 3,6 нг/мл связан с чрезмерным ответом яичников и риском развития синдрома гиперстимуляции яичников (СГЯ) в программах ВРТ [28].
- Определение уровня фолликулостимулирующего гормона (ФСГ) в крови на 2 - 5 дни менструального цикла (срок годности исследования - 1 год).
Комментарии:
уровень ФСГ >= 12 МЕ/л ассоциирован с плохим ответом на стимуляцию яичников и низкими шансами наступления беременности [29];
целесообразно одновременно исследовать уровень ФСГ и АМГ;
у женщин до 38 лет при оценке гормональных параметров овариального резерва внимание следует обращать как на уровень АМГ, так и на уровень ФСГ, у пациенток старше 38 лет более значимым показателем является базальная концентрация ФСГ [30].
- Определение количества антральных фолликулов (КАФ) при трансвагинальном ультразвуковом исследовании (УЗИ) в раннюю фолликулярную фазу цикла (срок годности исследования - 6 месяцев).
Комментарии:
КАФ представляет собой сумму антральных фолликулов в яичниках в ранней фолликулярной фазе цикла;
антральные фолликулы определяют, как фолликулы со средним диаметром 3 - 10 мм в наибольшей двумерной плоскости;
низкий овариальный резерв соответствует диапазону от 3 до 5 антральных фолликулов и связан с плохим ответом на овариальную стимуляцию, и низкими шансами наступления беременности [31].
Определение гормонов в крови включает:
- Определение базальной концентрации ФСГ, АМГ, пролактина (ПРЛ), ЛГ, эстрадиола (Е2), общего тестостерона (Т), тиреотропного гормона (ТТГ) и антител к тиреопероксидазе, которое проводится на 2 - 5-й день менструального цикла (срок годности исследования - 1 год).
Комментарий:
при олигоменорее гормональное обследование проводится на 2 - 5-й день собственного или индуцированного цикла, при аменорее - в любой день.
Посткоитальный тест (ПКТ)
- ПКТ, основанный на взаимодействии цервикальной слизи и спермы in vitro, не рекомендован для обследования женщин с бесплодием ввиду субъективности его результатов и отсутствия взаимосвязи с наступлением беременности [32].
Инструментальная диагностика
- УЗИ малого таза рекомендовано всем женщинам с бесплодием для определения размеров матки и яичников, диагностики новообразований матки и ее придатков, аномалий развития внутренних половых органов, патологических процессов в эндометрии (полипы, гиперплазия, хронический эндометрит), толщины эндометрия, а также определения КАФ (срок годности исследования - 6 месяцев).
- Оценка проходимости маточных труб проводится с помощью гистеросальпингографии (ГСГ) и/или соногистеросальпингографии, по показаниям - лапароскопии (срок годности исследования - 1 год). С помощью ГСГ и соногистеросальпингографии также определяют размер и форму полости матки, аномалии развития матки, приобретенные аномалии полости матки (субмукозная миома, полипы, внутриматочные синехии).
Комментарии:
ГСГ обладает низкой чувствительностью (50%) и низкой прогностической ценностью (30%) для диагностики полипов эндометрия и субмукозных миом [33];
экономическая рентабельность, доступность и высокая чувствительность (94%) ГСГ являются обоснованием применения этого метода в качестве рутинного для оценки состояния маточных труб на амбулаторном этапе обследования [34];
диагностическая ценность соногистеросальпингографии для диагностики состояния маточных труб не отличается от ГСГ [34].
- Магнитнорезонансная томография (МРТ) используется по показаниям для диагностики пороков развития внутренних половых органов, новообразований, распространенных форм эндометриоза, опухолей гипофиза, оценки состоятельности рубца на матке.
- Гистероскопия - заключительный метод диагностики при подозрении на внутриматочную патологию [33] (срок годности исследования - 1 год).
Комментарий:
целесообразно проведение гистероскопии при наличии 2-х и более переносов эмбрионов в программах ВРТ в анамнезе и при неэффективности консервативных методов лечения внутриматочной патологии для верификации диагноза.
- Лапароскопия - заключительный метод комплексной оценки состояния органов малого таза [35] (срок годности исследования - 1 год). Применяется при подозрении на трубный фактор бесплодия, спайках в малом тазу, подозрении на эндометриоз, пороках развития внутренних половых органов [36], [37], [38].
Уровень доказательности 1A.
Комментарии:
лапароскопия не рекомендована в качестве первого скринингового метода оценки проходимости маточных труб без предварительного обследования на амбулаторном этапе с помощью менее инвазивных методик (ГСГ или соногистеросальпингографии);
при отсутствии эффекта лечения бесплодия консервативными методами и при неуточненном женском бесплодии лапароскопия часто способствует выявлению и устранению причины бесплодия;
женщинам с наличием показаний к лапароскопии в связи с возможностью интраоперпционной ревизии состояния маточных труб, в том числе с помощью хромогидротубации, нецелесообразно дооперационное обследование с помощью ГСГ или соногистеросальпингографии [39];
есть данные о повышении эффективности лечения бесплодия после диагностической лапароскопии, что объясняется санацией брюшной полости.
2.1.2. Обследование мужчины
- Проводится исследование эякулята мужа (партнера) (срок годности исследования - 6 месяцев).
2.2 Лечение
Эндоскопические методы
- Гистероскопия - ведущий метод лечения при наличии внутриматочной патологии (полип эндометрия, гиперплазия эндометрия, внутриматочные синехии, пороки развития матки, миома матки, аденомиоз, эндометрит, рубец на матке после оперативных вмешательств (кесарево сечение, миомэктомия)) [33].
- Лапароскопия - заключительный метод комплексной оценки состояния органов малого таза и хирургический этап лечения. Показана во всех случаях хирургических показаний: подозрении на трубный фактор бесплодия, спайках в малом тазу, подозрении на эндометриоз, пороках развития внутренних половых органов [35], [36], [37], [38].
Уровень доказательности 1A.
Комментарии:
показания к лапароскопии должны быть четко сформулированы в зависимости от возраста женщины, ее жалоб, формы бесплодия, клинической симптоматики (боли, аномальные маточные кровотечения и др.) и сопутствующей гинекологической и экстрагенитальной патологии;
женщинам с бесплодием, не имеющих клинической симптоматики, при наличии патозооспермии у партнера, независимо от состояния маточных труб (исключая гидросальпинксы), целесообразно лечение в программах ВРТ;
сочетанное применение программ ВРТ и лапароскопии (при наличии показаний) увеличивает эффективность лечения бесплодия;
сочетанное применение лапароскопии и гистероскопии значительно увеличивает диагностическую точность причин бесплодия и, как следствие, эффективность лечения бесплодия.
2.3 Профилактические мероприятия
Специфической профилактики бесплодия нет, однако рекомендуется следовать следующим положениям:
- своевременное и эффективное лечение ВЗОМТ и ИППП;
- защищенные половые контакты (использование презервативов) во избежание заражения ИППП;
- профилактика абортов;
- соблюдение правил личной гигиены;
- отсутствие вредных привычек;
- нормализация менструальной функции;
- нормализация ИМТ;
- регулярное посещение гинеколога (1 раз в год);
- исключение чрезмерных физических и психоэмоциональных нагрузок;
- нормализация половой функции (регулярная половая жизнь).
3. Генетическое консультирование при бесплодии
Снижение фертильности может быть обусловлено генетическими факторами [40].
Медико-генетическое консультирование показано:
- при наличии наследственного (врожденного) заболевания у одного из родителей, детей или родственников;
- при рождении ребенка (беременности плодом) с хромосомной патологией или врожденными пороками развития;
- при носительстве хромосомной патологии у одного из супругов;
- при нарушении полового развития, в том числе при первичной аменорее.
Также медико-генетическое консультирование показано [41]:
- при бесплодии неясного генеза;
- при привычном выкидыше (2 и более самопроизвольных прерываний беременности в анамнезе);
- при повторных неудачных попытках переноса "свежих" или размороженных эмбрионов (3-х попытках - у женщин моложе 35 лет, 2-х попытках - у женщин 35 лет и старше);
- при тяжелых нарушениях сперматогенеза у мужчин (олигоастенотератозооспермия, олигозооспермия, азооспермия);
- при близкородственном браке супругов;
- донорам ооцитов, спермы и эмбрионов.
Консультирование пациентов с бесплодием должно включать сбор и оценку информации об анамнезе жизни и заболевания, сбор наследственного анамнеза (составление и анализ родословной), осмотр с целью оценки стигмдизэмбриогенеза, ознакомление с данными пройденного лабораторно-инструментального обследования.
При наличии показаний проводится кариотипирование обоих супругов и тестирование на частые патогенные варианты, приводящие к моногенным заболеваниям. Выбор вариантов следует производить с учетом особенностей популяции при участии врача-генетика.
4. Женское бесплодие, связанное с отсутствием овуляции (МКБ-10/N97.0)
4.1. Определение, классификация, диагностика и лечение
Определение
Эндокринное бесплодие - отсутствие беременности в течение 12 месяцев, связанное с нарушением овуляции: ановуляцией (отсутствием овуляции) или олигоовуляцией (редкими овуляциями).
Этиология и патогенез
Нарушения на различных уровнях гипоталамо-гипофизарно-яичниковой системы, а также другие заболевания эндокринных желез приводят к дисфункции гипоталамо-гипофизарно-яичниковой оси, формированию ановуляции и бесплодия [42].
Эпидемиология
В структуре бесплодного брака частота встречаемости эндокринного бесплодия составляет 25% [43], [44].
Классификация
ВОЗ классифицирует нарушения овуляции на 4 группы [43]:
Группа I: гипогонадотропная гипоэстрогенная ановуляция (функциональная гипоталамическая аменорея, гипогонадотропный гипогонадизм);
Группа II: нормогонадотропная нормоэстрогенная ановуляция (синдром поликистозных яичников - СПКЯ);
Группа III группа: гипергонадотропная гипоэстрогенная ановуляция (преждевременная недостаточность яичников, дисгенезия гонад);
Группа IV: гиперпролактинемия.
Диагностика
Диагноз эндокринного бесплодия устанавливают на основании единого алгоритма обследования, описанного в разделе "Диагностика женского бесплодия".
Лечение
- основной метод достижения беременности при эндокринных формах бесплодия - овариальная стимуляция для естественного зачатия;
- лечение бесплодия в программах ВРТ рекомендовано при неэффективности циклов овариальной стимуляции.
Показаниями для применения методов ВРТ:
- созревание в цикле овариальной стимуляции более 3-х фолликулов;
- неэффективность циклов овариальной стимуляции;
- сочетание с другими факторами бесплодия (мужское, трубно-перитонеальное).
4.2. Группа I. Гипогонадотропная гипоэстрогенная ановуляция
Определение. Данная группа нарушений включает функциональную гипоталамическую аменорею (ФГА), реже гипогонадотропный гипогонадизм (в т.ч. синдром Кальмана), гипопитуитаризм. Для этих состояний, характерна первичная или вторичная аменорея, характеризующаяся низким уровнем гонадотропинов и эстрогенов в сыворотке крови.
Эпидемиология. В структуре эндокринного бесплодия частота встречаемости гипогонадотропной гипоэстрогенной ановуляции составляет примерно 10%. Распространенность ФГА в популяции достигает 3 - 5%, гипогонадотропного гипогонадизма - 1 - 10 случаев на 10 000 [45].
Этиология. Гипогонадотропный гипогонадизм - мультигенное заболевание, связанное с мутациями генов, участвующих в онтогенезе и миграции нейронов гонадотропин-рилизинг гормона (ГнРГ), а также генов, регулирующих секрецию ГнРГ. Развитие функциональной гипоталамической аменореи ассоциировано со стрессовыми событиями, потерей массы тела или чрезмерными физическими нагрузками.
Клинико-лабораторная характеристика:
- отсутствие самостоятельных менструаций, реже - олигоменорея;
- низкие концентрации гонадотропинов (ЛГ < 3,0 МЕ/л) и Е2 в сыворотке крови;
- отрицательная проба с гестагенами (реже - положительная проба при ФГА);
- положительная эстроген-прогестероновая проба.
Рекомендации по лечению бесплодия [45]
- Индукцию овуляции у женщин с ФГА рекомендовано проводить только после достижения ИМТ > 18,5 кг/м2 ввиду повышенного риска акушерских осложнений (потеря плода, рождение детей с малым весом для гестационного возраста, преждевременные роды и кесарево сечение).
Уровень доказательности 3B.
- В случае расстройств приема пищи рекомендуется консультация диетолога и психотерапевта для проведения когнитивной поведенческой терапии.
- У пациенток с ФГА при достаточном уровне эстрадиола для овариальной стимуляции можно использовать кломифен.
Уровень доказательности 2A.
- Для овариальной стимуляции следует использовать препараты группы менотропинов, содержащих комбинацию ФСГ и ЛГ.
- Овариальная стимуляция гонадотропинами должна проводиться под строгим УЗ мониторингом.
Уровень доказательности 1A.
- В случае неэффективности овариальной стимуляции с использованием непрямых/прямых индукторов овуляции рекомендовано проведение программ ВРТ.
4.3. Группа II. Нормогонадотропная нормоэстрогенная ановуляция (синдром поликистозных яичников) (МКБ-10/E28.2)
Определение. Синдром поликистозных яичников (СПКЯ) - это эндокринопатия у женщин репродуктивного возраста, ассоциированная с гиперандрогенией, ановуляторным бесплодием, метаболическими нарушениями.
Эпидемиология. В структуре эндокринного бесплодия частота нормогонадотропной нормоэстрогенной ановуляции достигает 85%. Частота в популяции составляет 8 - 13% [46].
Этиология и патогенез. В генезе СПКЯ играют роль генетические и эпигенетические факторы.
Рекомендации по лечению бесплодия при СПКЯ:
- изменение образа жизни с целью нормализации массы тела;
- использование кломифена в качестве первой линии терапии;
- при неэффективности кломифена в качестве второй линии терапии проводится овариальная стимуляция гонадотропинами или лапароскопия;
Комментарий:
визуально неизмененные и мулътифолликулярные яичники рекомендуется не подвергать какой-либо травматизации, включая воздействие моно- и биполярной коагуляции;
больным СПКЯ, которым планируется лечение с применением ВРТ, оперативное лечение рекомендуется не проводить.
- при неэффективности овариальной стимуляции и лапароскопии показано проведение программ ВРТ.
Подробные данные, касающиеся диагностики и лечения женщин с СПКЯ, включая показания к программам ВРТ, представлены в клинических рекомендациях, утвержденных Министерством здравоохранения РФ.
4.4. Группа III. Гипергонадотропная гипоэстрогенная ановуляция (МКБ-10/E28.3)
Определение. Группа заболеваний, включающих первичную и вторичную формы преждевременной недостаточности яичников (ПНЯ), сопровождающихся олигоменореей или аменореей, повышением уровней гонадотропинов (преимущественно ФСГ) и снижением концентрации эстрадиола и тестостерона в сыворотке крови.
Эпидемиология. В структуре эндокринного бесплодия частота встречаемости гипергонадотропной гипоэстрогенной ановуляции составляет примерно 5%. Распространенность в популяции достигает 1 - 2% [22].
Этиология и патогенез. Различают первичную форму яичниковой недостаточности (дисгенезия гонад) и вторичную форму (генетическая, идиопатическая, аутоиммунная, ятрогенная формы).
Клинико-лабораторная характеристика:
- олигоменорея или отсутствие менструаций в течение 4 - 6 месяцев;
- уровень ФСГ в крови более 25 МЕ/л в 2-х исследованиях с интервалом не менее 4 недель;
- снижение уровня Е2 в крови.
Рекомендации по лечению бесплодия у пациенток с ПНЯ [47]:
- рекомендуется проведение программ ВРТ;
- при ПНЯ рекомендована донация ооцитов.
Комментарий:
женщины с ПНЯ должны быть проинформированы об отсутствии надежных и доказанных вмешательств, способных повысить функцию яичников и увеличить частоту естественного зачатия.
4.5. Группа IV. Гиперпролактинемия (МКБ-10/E22.1)
Определение. Синдром, проявляющийся повышением уровня пролактина в сыворотке крови. Может сопровождаться нарушением менструального цикла, бесплодием, галактореей, метаболическими нарушениями [48].
Этиология и патогенез. Гиперпролактинемия опухолевого генеза обусловлена лактотрофными аденомами гипофиза (пролактиномами), которые составляют почти 40% всех опухолей гипофиза. Гиперпролактинемия неопухолевого генеза (функциональная) встречается при заболеваниях почек, первичном гипотиреозе, при приеме нейролептиков, антидепрессантов, антиконвульсантов, опиатов, анестетиков, гипотензивных средств, комбинированных оральных контрацептивов и др. Об идиопатической гиперпролактинемии свидетельствует исключение возможных причин функционального повышения пролактина на фоне нормальной структуры гипоталамо-гипофизарной области по данным МРТ [49].
Эпидемиология. Распространенность гиперпролактинемии у женщин составляет 90 случаев на 100 000 с пиком распространенности в возрасте 25 - 34 лет. В структуре эндокринного бесплодия гиперпролактинемия может достигать 20%.
Диагностика и лечение. Данные, касающиеся диагностики, лечения и диспансерного наблюдения женщин с гиперпролактинемией различного генеза представлены в клинических рекомендациях, утвержденных Министерством здравоохранения РФ.
Рекомендации по лечению бесплодия у пациенток с гиперпролактинемией [48], [49]
- В качестве первого этапа помощи при лекарственно-индуцированной гиперпролактинемии рекомендовано отменить лекарственное средство, если это клинически возможно. В противном случае следует заменить препарат на аналогичный, но не вызывающий гиперпролактинемию. При невозможности перевода на другое лекарственное средство необходимо рассмотреть целесообразность назначения агонистов дофамина после консультации с лечащим врачом.
Уровень доказательности 3C.
- Рекомендовано проводить терапию агонистами дофамина для снижения уровня пролактина, уменьшения размеров опухоли, восстановления функции гонад у пациенток с симптоматическими пролактин-секретирующими аденомами.
Уровень доказательности 1A.
- При выборе препарата агонистов дофамина необходимо отдавать предпочтение каберголину, потому что он более эффективен в отношении нормализации уровня пролактина и уменьшения размеров опухоли гипофиза.
Уровень доказательности 1A.
- Наиболее благоприятным фоном для зачатия является полная нормализация уровня пролактина и уменьшение размеров опухоли менее 10 мм.
Уровень доказательности 3B.
- Пациенткам с микро- или макроаденомами, резистентными к лечению агонистами дофамина, или в случаях непереносимости медикаментозной терапии, целесообразно рассмотреть вопрос о проведении хирургического лечения.
Уровень доказательности 2B.
- При подтверждении факта наступления беременности терапию агонистами дофамина следует отменить.
Уровень доказательности 1A.
5. Женское бесплодие трубного происхождения (МКБ-10/N97.1)
Определение. Трубное бесплодие обусловлено нарушением проходимости маточных труб вследствие аномалии развития, в результате перенесенного воспаления (сальпингита) или отсутствия маточных труб. В воспалительный процесс могут вовлекаться яичник (сальпигооофорит, аднексит) и брюшина малого таза. Бесплодие, связанное с сочетанием непроходимости маточных труб и спаечным процессом, в отечественной практике получило название "трубно-перитонеальное".
Этиологические факторы:
- ВЗОМТ;
- внутриматочные манипуляции, в том числе искусственные аборты и диагностические выскабливания полости матки;
- перенесенные ранее оперативные вмешательства на органах малого таза и брюшной полости;
- эндометриоз;
- туберкулез внутренних половых органов.
Эпидемиология. Частота трубно-перитонеального бесплодия в России - 25 - 70% [50].
Диагностика
Рекомендовано проведение ГСГ или соногистеросальпингография для оценки состояния маточных труб.
Возможные результаты при ГСГ:
- непроходимость маточных труб в интерстициальном или истмическом отделах (визуализация маточных труб до истмического отдела);
- непроходимость маточных труб в ампулярном отделе (визуализация маточных труб на всем протяжении, отсутствие излития контрастного вещества в брюшную полость);
- увеличение размеров маточных труб (сактосальпинксы);
- неравномерное распределение контрастного вещества в малом тазу, подтянутость труб к костям таза, излитие контраста в небольшом количестве (затрудненная проходимость труб).
Лечение
- Консервативное лечение, направленное на достижение беременности при трубноперитонеальном бесплодии, неэффективно.
- Метод достижения беременности 1-й линии - применение ВРТ.
- Лапароскопия проводится при наличии показаний [51].
Уровень доказательности C.
Виды реконструктивно-пластических операций при трубно-перитонеальном бесплодии с использованием эндовидеохирургии:
- сальпинголизис (освобождение маточных труб от деформирующих их спаечных сращений);
- фимбриопластика (восстановление входа в воронку маточной трубы);
- сальпингостомия (создание нового отверстия в заращенном ампулярном отделе);
- тубэктомия при наличии гидросальпинксов перед применением ВРТ.
Критерии отбора для хирургического лечения [51]:
- возраст до 35 лет;
- сохраненный овариальный резерв;
- подтвержденная овуляция;
- отсутствие патозооспермии у партнера.
Комментарии:
при наличии гидросальпинксов рекомендуется удаление измененных маточных труб;
повторные реконструктивно-пластические операции на маточных трубах для восстановления их проходимости и достижения беременности не показаны ввиду их неэффективности.
6. Женское бесплодие маточного происхождения (МКБ-10/N97.2)
Определение. Патологический процесс, нарушающий анатомо-функциональное состояние матки и процесс имплантации. Определение включает врожденные аномалии развития матки, отсутствие матки и приобретенные поражения матки, нарушающие процесс имплантации.
Этиология и патогенез. Врожденные аномалии матки формируются в результате воздействия различных повреждающих факторов на этапах эмбрионального развития (или антенатально). Приобретенные поражения матки возникают как следствие перенесенных ВЗОМТ, изменения гормонального гомеостаза, хирургических манипуляций на матке.
Эпидемиология. В структуре причин женского бесплодия частота маточного фактора составляет около 50% [50].
По МКБ-10 объединяет коды:
Q51 - врожденные аномалии половых органов;
Q51.1 - удвоение тела матки с удвоением влагалища и шейки матки;
Q51.2 - другие удвоения матки;
Q51.3 - двурогая матка;
Q51.4 - однорогая матка;
N71.1 - хроническая воспалительная болезнь матки;
N71.9 - воспалительная болезнь матки неуточненная;
N84.0 - полип тела матки;
N84.1 - полип шейки матки;
D25 - лейомиома матки;
D26 - другие доброкачественные новобразования матки;
N85.6 - внутриматочные синехии.
Диагностика
Жалобы и анамнез. Рекомендуется при опросе пациентки особенно обращать внимание на наличие маточных кровотечений, перименструальных и межменструальных кровянистых выделений, болевого синдрома, ранее перенесенных ИППП, внутриматочных манипуляций.
Инструментальная диагностика:
- УЗИ органов малого таза (для кодов Q51; N84; D25; D26; N71.1; N71.9);
- гистероскопия (с биопсией эндометрия при необходимости) (для кодов Q51; N71; N84; N85; D25; D26);
- соногистеросальпингоскопия (для кодов Q51; N84; D25);
- ГСГ (для кодов Q51; N84; D25);
- МРТ (для кодов Q51; D25).
Лечение
- Метод достижения беременности 1-й линии - хирургическое лечение (лапаро-гистероскопия) (для кодов Q51; N84.1; N84.1; N71.1; N71.2).
- Выбор и объем хирургического пособия определяется особенностями патологических изменений матки и ее полости.
- Консервативное лечение оправдано после проведения хирургического вмешательства только в качестве компонента комплексного восстановительного лечения, для улучшения условий наступления беременности.
Комментарий:
длительность и выбор консервативной терапии в послеоперационном периоде определяется характером патологических изменений матки и объемом хирургического вмешательства.
- Лечение в программах ВРТ - при отсутствии внутриматочной патологии.
Комментарии:
период времени для ожидания наступления беременности после операции на матке - не более 1 года при условии проходимости маточных труб, сохраненной овуляции, нормальном овариальном резерве и отсутствии мужского фактора бесплодия;
при отсутствии хотя бы одного из этих условий показано направление для лечения в программах ВРТ по окончанию восстановительного периода после операции, определяемого видом и объемом хирургического лечения.
Операции при маточной форме бесплодия:
- выскабливание полости матки под контролем гистероскопа (при наличии гиперплазии эндометрия);
- удаление полипа эндометрия с использованием гистероскопических манипуляторов;
- удаление субмукозного миоматозного узла, внутриматочных синехий, инородного тела в матке, перегородки полости матки.
6.1. Лейомиома матки
Определение. Лейомиома матки - доброкачественная, хорошо ограниченная, капсулированная опухоль, происходящая из гладкомышечных клеток шейки или тела матки, одна из наиболее распространенных доброкачественных опухолей женской половой системы, которая возникает у 20 - 40% женщин репродуктивного возраста.
Комментарий:
данные, касающиеся диагностики, лечения и диспасерного наблюдения женщин с миомой матки, представлены в клинических рекомендациях, утвержденных Министерством здравоохранения РФ.
Влияние миомы матки на способность к зачатию [52]
- Субсерозная миома не оказывает существенного влияния на способность к зачатию.
Уровень доказательности 3B.
- Интрамуральная миома может быть связана с уменьшением вероятности зачатия и увеличением частоты самопроизвольных выкидышей.
Уровень доказательности 3B.
- Субмукозная миома связана с уменьшением вероятности зачатия и увеличением частоты самопроизвольных выкидышей.
Уровень доказательности 3B.
- Эффект множественной лейомиомы различного размера на вероятность зачатия и рождаемость является неопределенным и требует изучения.
Уровень доказательности 3B.
Влияние миомэктомии на фертильность [52]
- При интрамуральной лейомиоме недостаточно данных для оценки результатов.
Уровень доказательности 2A.
- При субмукозной лейомиоме есть данные об улучшении фертильности.
Уровень доказательности 2A.
- При больших размерах узла и большом количестве узлов миомэктомия может улучшать естественную фертильность.
Уровень доказательности 3B.
Лечение лейомиомы у женщин с бесплодием [52]
- Лекарственные средства не рекомендуются для консервативного лечения лейомиомы.
Уровень доказательности 3B.
- Агонисты гонадотропин-рилизинг гормона (аГнРГ) могут быть использованы краткосрочно для предоперационой подготовки у пациенток с анемией.
Уровень доказательности 1A.
- Хирургическое лечение может служить предварительным этапом для восстановления естественной фертильности и быть этапом подготовки к программам ВРТ.
Показания к хирургическому лечению:
- субмукозная лейомиома матки;
- интрамуральная лейомиома матки, деформирующая полость матки или имеющая признаки нарушения питания;
- субсерозная лейомиома матки с перешеечным расположением узла или при больших размерах узла (более 4 - 5 см) или имеющая признаки нарушения питания.
Комментарий:
нет данных о несомненной пользе применения внутриматочных спиралей, эстрогенов, антиадгезивных систем, катетра Foley после гистероскопической миомэктомии при субмукозной миоме матки [53].
Уровень доказательности 3C.
Программы ВРТ могут быть рекомендованы при наличии:
- одиночных или множественных интерстициальных миоматозных узлах до 4 - 5 см в диаметре, не деформирующих полость матки и не имеющих признаков нарушения питания;
- одиночных или множественных субсерозных миоматозных узлах небольших размеров (до 4 - 5 см) и не имеющих признаков нарушения питания.
Комментарий:
наличие интрамуральной лейомиомы больших размеров (более 4 - 5 см) и/или субмукозной лейомиомы является противопоказанием к проведению лечения с применением ВРТ и ВМИ.
6.2. Внутриматочные синехии
Определение. Внутриматочные синехии представляют собой патологию эндометрия, при которой происходит нарушение анатомической целостности полости матки за счет образования фибринозных спаек различной степени выраженности. Частота внутриматочных синехий по данным разных авторов колеблется от 0,3% до 21,5% [54].
Этиология и патогенез. Повреждение базального слоя эндометрия приводит к частичной или полной облитерации полости матки с поверхностью дефектного эндометрия и формированием волокнистых синехий между стенками матки [55].
Эпидемиология. В 90% случаев развитие выраженных внутриматочных синехий обусловлено осложненным течением беременности в связи с неполным абортом, неразвивающейся беременностью, пузырным заносом, послеродовым кровотечением, остатками плацентарной ткани [56]. Синдром Ашермана встречается после неполного аборта в 50%), послеродового кровотечения - в 24% и артифициального аборта - в 17,5% случаев [53]. При повторном кюретаже полости матки вероятность развития синехий увеличивается на 8% и достигает 30% при проведении манипуляции в третий раз. При неразвивающейся беременности вероятность возникновения внутриматочных синехий зависит от периода времени, прошедшего между гибелью эмбриона (плода) и эвакуацией его из полости матки, достигая 31%. Наложение компрессионных швов при послеродовом кровотечении в последующем способствует формированию внутриматочных синехий [57].
Жалобы [58]:
- нарушения менструального цикла по типу аменорея или гипоменореи;
- бесплодие и невынашивание беременности.
Инструментальная диагностика:
- УЗИ органов малого таза [55];
- ГСГ [33];
- соногистеросальпингография;
- гистероскопия.
Комментарий:
высокая стоимость МРТ и сложность интерпретации полученных результатов не дают возможность применить этот метод в качестве скринингового [56].
Лечение
- Основной метод лечения - гистероскопический адгезиолизис [56].
Комментарии:
для проведения гистероскопического адгезиолизиса используются различные хирургические энергии: механическая, электрическая, лазерная;
критериями успешности гистероскопического адгезиолизиса являются: восстановление нормальной анатомии полости матки, возобновление менструального цикла, наступление беременности [59].
- Эффективность хирургического лечения внутриматочных синехий составляет 85 - 90%, при этом репродуктивная функция восстанавливается всего у 23 - 35% женщин.
- Степень выраженности внутриматочных синехий до гистероскопического адгезиолизиса в последующем влияет на вероятность наступления беременности и составляет у пациенток с легкой, средней и тяжелой степенями 64,7%, 53,6% и 32,5% соответственно [60].
7. Женское бесплодие цервикального происхождения (МКБ-10/N97.3)
Определение. Форма бесплодия, обусловленная деформацией шейки матки, нарушающей транспорт сперматозоидов в матку.
Этиология и патогенез. Травмы и хирургические вмешательства на шейке матки способствуют формированию цервикальной формы бесплодия.
Эпидемиология. Данных о распространенности данной формы бесплодия нет.
Диагностика
Жалобы и анамнез. При опросе обращать внимание на перенесенные манипуляции на шейке матки.
Лабораторной диагностики не существует.
Комментарий:
ПКТ не должен использоваться для диагностики бесплодия цервикального происхождения ввиду субъективности его результатов и отсутствия взаимосвязи с наступлением беременности [32].
Инструментальное обследование:
- кольпоскопия;
- офисная цервико- и гистероскопия.
Лечение:
- хирургическая коррекция;
- программы ВРТ.
8. Женское бесплодие, комбинированное с мужскими факторами (МКБ-10/N97.4, N46)
Эпидемиология. Точные сведения о частоте бесплодия в супружеских парах связанного с комбинацией женских и мужских факторов, отсутствуют.
Комментарий:
в оригинале на английском языке в МКБ-10 данный вид бесплодия определяется как "female infertility associated with male factors", но "associated" имеет также значение "united, combined", т.е. "сочетанный, комбинированный";
в отечественной практике сочетанным женским бесплодием называется сочетание нескольких причин у женщины, сочетанным мужским бесплодием - сочетание нескольких причин у мужчины, комбинированным бесплодием - комбинация женских и мужских причин бесплодия у супругов/партнеров.
Фертильность мужчин может снижаться в результате следующих факторов:
- врожденных или приобретенных аномалий мочеполовых органов;
- злокачественных новообразований;
- инфекций мочеполовой системы;
- повышения температуры мошонки (например, при варикоцеле);
- эндокринных нарушений;
- генетических дефектов;
- аутоиммунных реакций.
У 30 - 40% мужчин причину бесплодия выявить не удается, и такое бесплодие относят к идиопатическому. У мужчин с идиопатическим бесплодием нет заболеваний, нарушающих фертильность, отсутствуют изменения при физикальном исследовании, гормональные, генетические и биохимические показателей не имеют отклонений от нормальных значений. При этом в анализе эякулята у них выявляются патологические изменения. Идиопатическое мужское бесплодие может быть следствием патологических процессов, обусловленных влиянием генетических или эпигенетических факторов, загрязнения окружающей среды, воздействия свободных радикалов кислорода. Не все причины мужского бесплодия могут быть диагностированы и устранены [61].
Диагностика
Врач-уролог проводит обследование мужчин, состоящих в бесплодном браке, руководствуясь клиническими рекомендациями общества урологов. Обследование мужчин должно предшествовать обследованию женщины, поскольку фертильный статус женщины может влиять на выбор тактики лечения, включая применение ВРТ или искусственной инсеминации, и его результат [61], [62], [63].
Лабораторная диагностика
Основным методом оценки фертильности мужчины является оценка показателей эякулята (исследование макроскопических и микроскопических параметров) [64]. Минимальные референсные значения показателей эякулята представлены в таблице 1.
Таблица 1. Минимальные референсные значения показателей эякулята (5-й процентиль и 95%-й доверительный интервал) согласно руководству ВОЗ по исследованию и обработке эякулята человека, 2010 г.
|
Показатель
|
Минимальное референсное значение
|
|
Объем эякулята (мл)
|
1,5 (1,4 - 1,7)
|
|
Общее количество сперматозоидов в эякуляте (106 на эякулят)
|
39 (33 - 46)
|
|
Концентрация сперматозоидов (106 на мл)
|
15 (12 - 16)
|
|
Общая подвижность (PR + NP, %)
|
40 (38 - 42)
|
|
Прогрессивная подвижность (PR, %)
|
32 (31 - 34)
|
|
Жизнеспособность (живые сперматозоиды, %)
|
58 (55 - 63)
|
|
Морфология сперматозоидов (нормальные формы, %)
|
4,0 (3,0 - 4,0)
|
|
Пероксидаза-положительные лейкоциты (106 на мл)
|
< 1,0
|
Аномальные результаты анализа эякулята являются показаниями к обследованию мужчин врачом-урологом.
Лечение
Врач-уролог проводит лечение мужчин, состоящих в бесплодном браке, руководствуясь клиническими рекомендациями общества урологов. Бесплодным мужчинам, которым не удается обеспечить возможность зачатия естественным путем, показано применение ВРТ. Этому должно предшествовать обследование мужчин с целью установления диагноза и причин бесплодия, а также выявления возможных противопоказаний к использованию ВРТ [65].
9. Другие формы бесплодия (МКБ-10/N97.8)
Эндометриоз (МКБ-10/N80)
Определение. Эндометриоз - процесс, при котором за пределами полости матки происходит разрастание ткани, по морфологическим и функциональным свойствам подобной эндометрию [66].
Этиология и патогенез. В основе развития эндометриоза лежит иммуновоспалительная реакции тканей в ответ на выживание и рост эндометриоидных клеток в условиях гиперэстрогении, что сопровождается чрезмерной продукцией провоспалительных цитокинов, простагландинов и приводит к формированию болевого синдрома, бесплодия и невынашивания беременности. Факторами, способствующими развитию эндометриоза, являются: ухудшение экологии, снижение иммунитета, стресс, алкоголь, ранние, обильные и длительные менструации, обструктивные пороки развития, внутриматочные спирали, спонтанные и искусственные аборты [67].
Эпидемиология. Частота выявления эндометриоза при лапароскопии, проводимой в целях уточнения причины бесплодия, составляет от 20% до 50% [68].
Диагностика
- Диагноз эндометриоза может быть установлен только при лапароскопии с патоморфологическим исследованием удаленной ткани [69].
Уровень доказательности 1A.
Комментарий:
классификация, клиническая симптоматика, диагностика и лечение эндометриоза представлены в клинических рекомендациях, утвержденных Министерством здравоохранения РФ.
Лечение
Последовательность этапов лечения у женщин с бесплодием определяется клинической симптоматикой и стадией заболевания.
Хирургическое лечение [70]:
- Эндоскопическая диагностика, хирургическое вмешательство с деструкцией или удалением пораженной ткани и максимальным сохранением яичниковой ткани.
Уровень доказательности 1A.
- Удаление эндометриомы повышает шансы наступления беременности.
Уровень доказательности 2A.
- При проведении повторных операций на яичнике при эндометриомах у женщины с бесплодием необходимо оценить риск и пользу предполагаемого вмешательства.
Уровень доказательности 1A.
Комментарий:
проведение повторных операций, направленных на восстановление естественной фертильности, при отсутствии показаний неоправданно затягивает применение программ ВРТ [67].
Консервативное лечение
- Медикаментозная терапия эндометриоза прогестагенами и аГнРГ рекомендуется только для лечения болевого синдрома при эндометриозе [67].
Уровень доказательности 1A.
- Медикаментозная терапия у женщин с эндометриозом 1 - 2 стадии при сохраненной проходимости маточных труб и фертильной сперме партнера не увеличивает шансы наступления беременности [71].
Комментарии:
период ожидания наступления беременности после хирургического вмешательства должен составлять не более 6 месяцев;
при отсутствии беременности в течение 6 месяцев целесообразно предложить программы ВРТ [67].
- Программы ВРТ после хирургического лечения следует рекомендовать женщинам с эндометриозом 3 - 4 стадии и нарушением проходимости маточных труб независимо от возраста пациентки и фертильности мужа [72].
Уровень доказательности 1A.
- Медикаментозная терапия аГнРГ в течение 3 - 6 месяцев при распространенном инфильтративном эндометриозе улучшает частоту наступления беременности перед применением ВРТ [67].
Уровень доказательности 1B.
- У женщин с бесплодием и эндометриомой рекомендуется провести мероприятия, направленные на верификацию диагноза для решения вопроса о необходимости хирургического лечения или возможности проведения ВРТ [67].
Уровень доказательности 1A.
- Различия в эффективности протоколов с аГнРГ и антагонистов ГнРГ (антГнРГ) в программах ВРТ при эндометриозе не доказаны [67].
Уровень доказательности 1A.
- Преимуществом может обладать супердлинный протокол с аГнРГ при инфильтративном, распространенном эндометриозе [67].
Уровень доказательности 1B.
- При аденомиозе 1 - 2 стадии распространения не требуется дополнительного лечения перед применением ВРТ. При аденомиозе 3 - 4 стадии распространения назначение аГнРГ в течение 3 - 4 месяцев увеличивает частоту наступления беременности в программах ВРТ.
Уровень доказательности 2B.
- При распространенных формах аденомиоза оперативное лечение показано только при наличии узловой формы [67].
Уровень доказательности 2B.
Комментарии:
частота наступления беременности у пациенток с аденомиозом 3 - 4-й стадии не превышает 10 - 15%, так как ни один из видов лечения не позволяет создать благоприятных условий имплантации в связи с выраженными нарушениями рецептивности эндометрия;
необходимо информировать женщину о низкой вероятности наступления беременности и возможности реализации репродуктивной функции с использованием "суррогатного" материнства [73].
10. Женское бесплодие неуточненное (МКБ-10/N97.9)
Определение. Бесплодие "неясного генеза" - это форма бесплодия, когда в процессе обследования на амбулаторном этапе у супружеской пары не выявлены причины бесплодия, т.е. женщина имеет регулярный менструальный цикл, сохраненную овуляцию, сохраненный овариальный резерв, проходимые маточные трубы, и отсутствие указаний в анамнезе на ранее перенесенные гинекологические операции, а партнер - фертильную сперму.
Комментарий:
поскольку в МКБ-10 не разъяснены признаки этого диагноза, вероятно, под этим кодом можно шифровать и бесплодие "неясного генеза" или необъяснимое бесплодие, однако для этого диагноза может быть применен шифр N97.8 (другие формы бесплодия).
Эпидемиология. Частота встречаемости около 10%.
Диагностика. Алгоритм диагностики представлен в разделе "Диагностика женского бесплодия".
Лечение
- Не рекомендуется стимуляция овуляции кломифеном. Необходимо проинформировать пациентку о том, что нет увеличения шансов беременности на фоне применения кломифена при невыясненной причине бесплодия.
- Не рекомендуется предлагать этим парам протоколы овариальной стимуляции [74].
- Хирургическое лечение оправдано в качестве 2-й линии при безуспешных попытках лечения с применением ВРТ или по показаниям, возникающим в процессе лечения [75].
Уровень доказательности 1A.
- Данные об эффективности внутриматочной инсеминации (ВМИ) при данном виде бесподия противоречивы [76].
Комментарий:
ВМИ (как альтернатива вагинальному половому акту) в естественном менструальном цикле может быть рекомендована парам, которые не используют половые акты в связи с инвалидностью или психосексуальными проблемами.
11. Вспомогательные репродуктивные технологии (ВРТ)
К вспомогательным репродуктивным технологиям относятся следующие программы и методы:
- экстракорпоральное оплодотворение (ЭКО);
- инъекция сперматозоида в цитоплазму ооцита (ИКСИ);
- рассечение оболочки эмбриона (вспомогательный хетчинг);
- донорство спермы;
- донорство ооцитов;
- донорство эмбрионов;
- суррогатное материнство;
- криоконсервация гамет, эмбрионов;
- преимплантационное генетическое тестирование (ПГТ);
- операции по получению сперматозоидов для ИКСИ.
Клинические этапы проведения программ ЭКО и ИКСИ идентичны и включают:
- овариальную стимуляцию (стимуляцию яичников);
- пункцию фолликулов яичников и аспирацию ооцитов;
- перенос эмбриона/ов в полость матки (данный этап не производится при сегментации цикла);
- поддержку лютеиновой фазы;
- диагностику беременности.
Показатели эффективности программ ВРТ:
- биохимическая беременность (беременность, диагностированная только путем определения 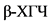 в сыворотке крови или в моче);
в сыворотке крови или в моче);
- клиническая беременность (беременность, диагностированная путем визуализации при УЗИ одного или более плодных яиц, или наличия достоверных клинических признаков беременности; кроме маточной беременности, включает клинически подтвержденную эктопическую беременность);
- клиническая беременность с сердечной деятельностью плода (беременность, диагностированная на основании регистрации сердечной деятельности хотя бы одного плода с помощью УЗИ);
- частота имплантации (отношение числа визуализированных плодных яиц к числу перенесенных эмбрионов, %);
- частота наступления клинической беременности (количество клинических беременностей на 100 начатых циклов/циклов с аспирацией/переносов эмбрионов);
- частота родов (число родов на 100 начатых циклов/циклов с аспирацией/переносов эмбрионов);
- частота родов живым ребенком (количество родов, которые закончились рождением хотя бы одного живого ребенка в расчете на 100 начатых циклов/циклов с аспирацией/переносов эмбрионов);
- кумулятивная частота родов (на начатый цикл/пункцию) с рождением минимум одного живого ребенка (количество родов, рассчитанное на 100 начатых циклов с овариальной стимуляцией в программах ВРТ (на цикл) или с пункцией (на пункцию), в которых перенесены свежие и/или размороженные эмбрионы (до тех пор, пока не произойдут одни роды с рождением живого ребенка, или до тех пор, пока не будут использованы все эмбрионы, независимо от того, что произойдет первым; роды одним плодом, двойней или другие роды большим количеством плодов регистрируют как одни роды.).
Факторы, влияющие на эффективность программ ВРТ
- Возраст женщины. Эффективность программ ВРТ значительно снижается с увеличением возраста пациентки и после 40 лет не превышает 10%, после 43-летнего возраста приближается к нулевой отметке.
- Количество протоколов ЭКО в анамнезе. Вероятность родов в результате лечения бесплодия методами ВРТ снижается с увеличением числа неудачных циклов.
- Паритет. Эффективность программ ВРТ выше, если у пациентки были роды в анамнезе.
- Индекс массы тела. Перед применением ВРТ оптимальный ИМТ женщины составляет 19 - 30 кг/м2. Если ИМТ выходит за указанные пределы, вероятность успешного лечения с применением ВРТ будет снижена.
- Образ жизни. Курение одного из партнеров, избыточное употребление кофеина являются факторами неблагоприятного прогноза эффективности программ ВРТ.
Комментарий:
женщинам старше 35 лет, независимо от длительности бесплодия и его причины, целесообразно предлагать программы ВРТ, как наиболее эффективный метод достижения беременности.
11.1. Обследование при подготовке к программам ВРТ
При подготовке к программам ВРТ должно быть проведено следующее обследование:
Обоим супругам:
- определение иммуноглобулинов класса M и G к вирусу иммунодефицита человека 1, 2 (далее - ВИЧ 1,2) и антигена p24/25 (Agp24/25) (срок годности исследования - 3 месяца);
Комментарий:
согласно пунктам 4.3. санитарно-эпидемиологических правил СП 3.1.5.2826-10 "Профилактика ВИЧ инфекции", стандартным методом лабораторной диагностики ВИЧ-инфекции служит одновременное определение антител к ВИЧ 1,2 и антигена p24/25 ВИЧ с помощью диагностических тестов ИФА и ИХЛА.
- определение иммуноглобулинов класса M и G вирусам гепатита B и C в крови (срок годности исследования - 3 месяца);
- определение иммуноглобулинов класса M и G к Treponema pallidum в крови (срок годности исследования - 3 месяца);
- молекулярно-биологическое исследование соскоба из цервикального канала (для женщин) или уретры и/или эякулята (для мужчин) на выявление генетического материала Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis (срок годности исследования - 1 год);
Женщине:
- клинический анализ крови (срок годности исследования - 1 месяц);
- анализ крови биохимический общетерапевтический (срок годности исследования - 1 месяц);
- коагулограмма (ориентировочное исследование системы гемостаза) (срок годности исследования - 1 месяц);
- общий анализ мочи (срок годности исследования - 1 месяц);
- определение иммуноглобулинов класса M и G к Rubella в крови;
Комментарии:
при выявлении уровня иммуноглобулинов класса G, свидетельствующем о достаточном уровне иммунитета, анализ сдается однократно;
в случае отсутствия или недостаточном уровне иммуноглобулинов класса G показана вакцинация с планированием беременности не ранее, чем через 3 месяца после вакцинации согласно инструкции к применению вакцины.
- определение группы крови и резус-фактора (однократно);
- микроскопическое исследование мазка из цервикального канала и влагалища (срок годности исследования - 1 месяц);
- цитологическое исследование мазка с поверхности шейки матки и из цервикального канала (срок годности исследования - 1 год);
- молекулярно-биологическое исследование соскоба из цервикального канала на выявление генетического материала Herpes simplex 1,2, Cytomegalovirus (срок годности исследования - 1 год);
- УЗИ трансвагинальное органов малого таза (перед вступлением в программы ВРТ);
- флюорография легких (срок годности исследования - 1 год);
- электрокардиограмма (срок годности исследования - 1 год);
- консультация врача-терапевта (срок годности консультации - 1 год);
- обследование молочных желез: всем женщинам - УЗИ молочных желез на 7 - 11 день менструального цикла, с возраста 40 лет и старше - маммография, при обнаружении патологии консультация онколога (срок годности исследования - 1 год).
Мужчине:
- исследование эякулята (срок годности исследования - 6 месяцев).
В ряде случаев назначаются женщине консультации специалистов, показаниями к которым являются:
- консультация терапевта при наличии соматических заболеваний;
- консультация эндокринолога при наличии заболеваний эндокринной системы;
- консультация нейрохирурга при подозрении на микро- или макроаденому гипофиза;
- консультация онколога при подозрении на патологию молочных желез;
- консультации других специалистов при выявлении соответствующей патологии [74].
11.2. Овариальная стимуляция
Овариальная стимуляция/стимуляция яичников в программах ЭКО и ИКСИ - это фармакологическая стимуляция одномоментного развития и созревания пула фолликулов с целью получения нескольких/множества ооцитов при их пункции.
Принципы овариальной стимуляции:
- безопасность (профилактика СГЯ и других осложнений);
- эффективность (получение оптимального числа ооцитов);
- индивидуальный подход (длительность стимуляции, количество инъекций, и визитов к врачу, стоимость лечения).
Варианты ответа яичников:
- гиперэргический или избыточный (20 ооцитов и более);
- нормальный (10 - 19 ооцитов);
- субоптимальный (4 - 9 ооцитов);
- "бедный" (1 - 3 ооцита).
Препараты для овариальной стимуляции
С целью стимуляции яичников в протоколах ВРТ применяются менотропины, рекомбинантные гонадотропины, в том числе пролонгированного действия, реже - антиэстрогены. Для предотвращения преждевременного пика ЛГ используют аналоги ГнРГ - аГнРГ и антГнРГ.
- Комбинированные оральные контрацептивы (КОК) перед овариальной стимуляцией могут использоваться: при рецидивирующих функциональных кистах для профилактики их образования перед началом стимуляции; при СПКЯ; для синхронизации циклов донора ооцитов и реципиента или генетической и суррогатной матерей; при планировании дня начала овариальной стимуляции.
Комментарии:
негативного влияния применения КОК перед протоколами с аГнРГ не выявлено;
в протоколе с антГнРГ возможно негативное влияние КОК на исходы программ ВРТ [77].
Выбор протокола стимуляции:
Протокол с антГнРГ рекомендован пациенткам [78], [79], [80]:
- с избыточным овариальным резервом (АМГ более 3,6 нг/мл);
- с СПКЯ;
- с дефицитом массы тела;
- с нормальным овариальным резервом и первым предстоящим протоколом ЭКО или ИКСИ;
- донорам ооцитов;
- с СГЯ в анамнезе.
Протоколы с аГнРГ (длинный, короткий, супердлинный) рекомендованы [79], [80]:
- при отсутствии факторов риска развития СГЯ;
- при асинхронном росте фолликулов;
- при преждевременной овуляции на фоне протокола с антГнРГ;
- при необходимости длительной супрессии гипоталамо-гипофизарно-яичниковой системы при генитальном эндометриозе (супердлинный протокол).
Комментарий:
частота родов в протоколах с агонистами и антагонистами ГнРГ сопоставима [81];
преимущества протоколов с антГнРГ связаны со снижением риска развития СГЯ ввиду возможности замены триггера финального созревания ооцитов на аГнРГ. Эффективность фиксированного и гибкого вариантов протокола с антГнРГ по частоте наступления беременности сопоставимы.
Выбор гонадотропинов для овариальной стимуляции:
- С целью овариальной стимуляции в программах ЭКО и ИКСИ рекомендуется использовать как рекомбинантные, так и менопаузальные гонадотропины [82].
Уровень доказательности 1A.
Комментарий:
не выявлено различий по частоте наступления беременности, осложнениям и исходам беременности при сравнении использования рекомбинантных и менопаузальных гонадотропинов для стимуляции яичников в программах ВРТ.
в неселективной популяции пациентов преимущество добавления препаратов с ЛГ-активностью не доказано и рекомендуется использование препаратов, содержащих чистый ФСГ [83].
- Стартовая доза гонадотропинов определяется индивидуально на основе возраста, ИМТ и показателей овариального резерва пациентки [22].
Уровень доказательности 1A.
- У пациенток с избыточным овариальным резервом при риске СГЯ рекомендуется использовать низкие стартовые дозы гонадотропинов [84].
Уровень доказательности 1A.
Комментарий:
при низком овариальном резерве нецелесообразно увеличивать стартовую дозу препарата более 300 ME.
- Рекомендуется осуществлять УЗ мониторинг овариальной стимуляции [22].
Комментарий:
задачами мониторинга являются: определение условий для начала стимуляции; оценка ответа яичников (количество растущих фолликулов, их диаметр); оценка критериев назначения триггера финального созревания ооцитов; оценка толщины и структуры эндометрия.
Использование препаратов с ЛГ-активностью может быть рекомендовано пациенткам селективной группы [85]:
- с гипоталамо-гипофизарной недостаточностью;
- позднего репродуктивного возраста;
- с нормальным овариальным резервом, но субоптимальным ответом яичников на экзогенный ФСГ в предыдущих протоколах;
- с высокими курсовыми дозами ФСГ в предыдущих протоколах.
Уровень доказательности C.
Выбор триггера финального созревания ооцитов:
- В качестве триггера финального созревания ооцитов применяют препараты ХГЧ и аГнРГ.
- При риске развития СГЯ, в программах с донорскими ооцитами, а также в протоколах, где не планируется перенос эмбрионов (ПЭ), рекомендуется в качестве триггера финального созревания ооцитов использовать аГнРГ [86], [87].
Уровень доказательности 1A.
Комментарий:
критерий назначения триггера - наличие >= 3 фолликулов >= 17 мм в диаметре.
11.3. Пункция фолликулов яичников и аспирация ооцитов
Пункция фолликулов яичников - медицинская манипуляция с целью получения ооцитов.
- Для снижения риска влагалищного кровотечения и выраженности болевых ощущений, связанных с пункцией, рекомендуется использовать тонкие аспирационные иглы [88].
Уровень доказательности 1A.
Комментарии:
аспирация содержимого фолликулов проводится с использованием специальной вакуумной помпы, либо с помощью стерильных шприцев;
в редких случаях при невозможности выполнения трансвагинальной пункции (ТВП) (атипичное расположение яичников, выраженный спаечный процесс) ооциты могут быть получены лапароскопическим доступом.
- Пункцию фолликулов (аспирацию ооцитов) рекомендуется проводить через 34 - 38 часов после введения триггера финального созревания ооцитов [89], [90], [91], [92].
Уровень доказательности 2B.
Комментарии:
в клинической практике целесообразно назначение триггера за 35 - 36 часов до планируемой пункции: такая тактика позволяет свести к минимуму риски получения незрелых ооцитов и спонтанных овуляций;
манипуляция выполняется в условиях дневного стационара, в асептических условиях, может проводиться под местной (парацервикальная блокада) или под общей анестезией с помощью трансвагинального ультразвукового датчика со специальной насадкой и пункционных игл диаметром 17 - 20G.
- Промывание фолликулов во время аспирации у женщин с нормальным ответом яичников не повышает число полученных ооцитов [93].
Уровень доказательности 1A.
- Возможно назначение антибиотиков широкого спектра действия по показаниям [94].
11.4. Перенос эмбриона/ов в полость матки
Перенос эмбрионов - медицинская манипуляция, при которой эмбрионы переносят в полость матки женщины.
- ПЭ в полость матки рекомендуется осуществлять через 48 - 144 часа после получения и оплодотворения ооцитов, т.е. на 2 - 6 сутки развития [95].
Комментарии:
эмбрионы можно переносить в полость матки на 2-й или 3-й день после пункции фолликулов на 4 - 8 клеточной стадии развития;
продление срока культивирования до 5 - 6 дней приводит к селекции эмбрионов: часть эмбрионов останавливается в развитии, другая часть достигает стадии бластоцисты;
перенос на стадии бластоцисты позволяет выбрать наиболее жизнеспособные эмбрионы и повысить вероятность имплантации;
выбор дня ПЭ определяется в зависимости от числа, качества и характера дробления эмбрионов [96].
- Перед ПЭ проводится трансвагинальное УЗИ органов малого таза, во время которого измеряется длина цервикального канала и полости матки, толщина эндометрия, оценивается состояние яичников и наличие свободной жидкости в малом тазу.
- Рекомендовано аккуратное удаление слизи из области цервикального канала стерильным тампоном, смоченным физиологическим раствором или с помощью аспирации шприцем, соединенным с катетером [97], [98], [99].
Уровень доказательности 2B.
- Консенсуса, касающегося оптимального места для помещения эмбрионов в полости матки, нет. Однако с целью повышения вероятности наступления беременности, конец катетера рекомендуется располагать в верхней или средней трети полости матки на расстоянии не ближе 1 см от дна матки (15 - 20 мм от дна матки) [99].
Уровень доказательности 2B.
Комментарии:
важно свободное медленное прохождение катетера вдоль цервикального канала без использования дополнительных инструментов;
содержимое катетера вводится в полость матки с минимальной скоростью;
менее чем в 3% случаев эмбрионы остаются в катетере, поэтому после завершения процедуры необходимо проверить оставшееся в катетере содержимое на наличие эмбрионов;
если эмбрионы не были перенесены, их следует поместить в новый катетер и сделать повторный перенос.
- ПЭ рекомендуется проводить под УЗИ контролем, что повышает частоту наступления беременности и роды живым плодом [100], [99].
Уровень доказательности 1A.
- Рекомендуется использование мягкого катетера при ПЭ, что позволяет избежать травмы эндометрия и повышает вероятность наступления беременности [99].
Уровень доказательности 1B.
- Извлечение катетера из полости матки рекомендуется производить медленно сразу после завершения манипуляции [99], [101], [102].
Уровень доказательности 2B.
- Возможно применение среды, содержащей гиалуроновую кислоту, что, по данным литературы, увеличивает частоту наступления клинической беременности и родов живым плодом [103], [104].
Уровень достоверности доказательств 2B.
- Профилактическое применение антибиотиков перед ПЭ не повышает вероятность наступления беременности и нецелесообразно [99], [105].
Уровень доказательности 2B.
- Применение анестезии во время стандартного ПЭ не рекомендуется [106].
Уровень доказательности 4C.
- Данных о преимуществах постельного режима после ПЭ не получено.
Количество переносимых эмбрионов
- В клинической практике допускается перенос не более 2-х эмбрионов. Селективный перенос одного эмбриона рекомендуется с целью снижения риска наступления многоплодной беременности.
- Пациенткам с отягощенным акушерским анамнезом (невынашивание беременности, истмико-цервикальная недостаточность) и патологией матки (однорогая матка, рубец на матке, лейомиома матки и др.) показан селективный перенос 1 эмбриона.
Комментарий:
данные национальных регистров ВРТ (EIM, ESHRE) показывают, что в странах, где преимущественно осуществляется селективный перенос одного эмбриона, существенно ниже частота многоплодных беременностей [107].
При принятии решения о количестве переносимых эмбрионов, рекомендуется учитывать следующие факторы [108], [109]:
- возраст женщины;
- состояние матки;
- количество и качество эмбрионов (годных к переносу);
- исходы предыдущих попыток ВРТ.
Комментарий:
кумулятивная частота родов при переносе одного эмбриона сопоставима с таковой при переносе двух эмбрионов в одном лечебном цикле [110], [111].
- При переносе двух эмбрионов рекомендуется обязательно сообщить пациентам о вероятности и рисках многоплодной беременности [108].
Уровень доказательности 4C.
11.5. Поддержка лютеиновой фазы
- Одномоментное созревание нескольких фолликулов, и аспирация их содержимого являются причиной функциональной недостаточности желтых тел, в связи с чем, в программах ВРТ проводится гормональная поддержка лютеиновой фазы (ПЛФ) [112].
Уровень доказательности 1A.
- Гормональную ПЛФ рекомендуется начинать в день пункции яичников или первые 3 суток после нее. Консенсус относительно оптимального дня начала гормональной поддержки отсутствует [113].
Препараты, применяемые для ПЛФ.
- Для ПЛФ рекомендуется использовать препараты прогестерона [114].
Уровень доказательности 1A.
Комментарии:
дидрогестерон и вагинальный микронизированный прогестерон одинаково эффективны для поддержки лютеиновой фазы в циклах ВРТ [115];
преимущества сочетанного назначения микронизированного прогестерона и дидрогестерона для ПЛФ не доказаны [114];
не выявлено различий по частоте наступления клинической беременности в программах ВРТ при применении микронизированного прогестерона в виде капсул или в виде геля для интравагинального применения [116];
не выявлено различий по клиническим исходам в программах ВРТ при применении микронизированного прогестерона в виде капсул или в виде масляного раствора для внутримышечных инъекций [117].
- Препараты ХГЧ не рекомендуется использовать для ПЛФ из-за повышения риска развития СГЯ, связанного с механизмом их действия [114].
Уровень доказательности 2B.
- Не рекомендуется дополнительное назначение эстрогенов при толщине эндометрия 8 мм и более [118].
- Возможно дополнительное применение эстрогенов для ПЛФ при толщине эндометрия на момент переноса эмбриона менее 8 мм, а также женщинам с ПНЯ или при отсутствии яичников [119].
Уровень доказательности 4C.
- При подтверждении беременности в ряде случаев ПЛФ рекомендуется продолжать до срока 12 и более недель беременности [119].
Уровень доказательности 4C.
Особенности ПЛФ при использовании аГнРГ в качестве триггера овуляции
- В случаях применения аГнРГ в качестве триггера финального созревания ооцитов для ПЛФ рекомендуется использовать высокие дозы прогестерона и, дополнительно, назначать эстрогены [86].
Уровень доказательности 3C.
Комментарий:
при использовании аГнРГ в качестве триггера овуляции происходит выброс эндогенного ЛГ, обладающего более коротким периодом полураспада по сравнению с ХГЧ, что позволяет снизить риск развития СГЯ, но повысить риск преждевременного лютеолиза и дефекта лютеиновой фазы [120].
- Также в случаях применения аГнРГ в качестве триггера финального созревания ооцитов для ПЛФ возможно введение хорионического гонадотропина в день получения ооцитов и гормональный мониторинг для поддержания оптимального уровня стероидных гормонов в сыворотке крови для наступления беременности [121].
Особенности ПЛФ в программах ВРТ с переносом криоконсервированных/размороженных эмбрионов
- У женщин с нормальным менструальным циклом при отсутствии дефицита половых гормонов и нормальной толщине эндометрия применение эстрогенов не рекомендуется [122], [123].
Уровень доказательности 2B.
- Женщинам с ПНЯ или нерегулярным менструальным циклом рекомендуется циклическая гормональная терапия с назначением эстрогенов в фолликулярную фазу и гестагенов перед переносом размороженных эмбрионов, с продолжением сочетанной гормональной поддержки в посттрансферном периоде [119], [124], [125].
Уровень доказательности 3C.
11.6. Эмбриологический этап программ ВРТ
Ооциты могут быть оплодотворены методом ЭКО и/или методом ИКСИ.
11.6.1. Инсеминация ооцитов in vitro - экстракорпоральное оплодотворение (метод ЭКО)
Инсеминация ооцитов методом экстракорпорального оплодотворения заключается в совместном культивировании ооцитов и сперматозоидов, прошедших капацитацию in vitro.
- Рекомендуется использовать классический метод ЭКО при нормозооспермии и умеренной патозооспермии.
Уровень доказательности 4C.
Комментарий:
одни специалисты ориентируются на количество подвижных сперматозоидов в нативном эякуляте (> 1 x 106), другие - на количество подвижных сперматозоидов в обработанной сперме (> 0,2 - 0,5 x 106), третьи - на концентрацию и морфологию сперматозоидов в нативном образце (> 0,5 x 106 морфологически нормальных прогрессивноподвижных сперматозоидов в миллилитре) [126], [127], [128], [129].
- Для обработки спермы рекомендуется использовать такие методы, как центрифугирование в градиенте плотности и swim-up ("всплытие") [130].
Уровень доказательности 4C.
Комментарии:
рекомендовано придерживаться минимального объема при добавлении суспензии сперматозоидов для снижения риска аномального оплодотворения.
- После получения ооцит-кумулюсных комплексов (ОКК) необходимо провести предварительный нагрев сред для их отмывания до 37 °C и поддерживать постоянную температуру в пробирке, в которую помещают ОКК после аспирации, и чашке Петри, где проводится поиск и идентификация ОКК. Длительное культивирование ОКК в фолликулярной жидкости не рекомендовано [131].
Уровень доказательности 4A.
Комментарии:
необходимо подробно изучить инструкции по используемым средам в лаборатории ВРТ;
для снижения риска разрушения веретена деления в ооците все работы с ооцит-кумулюсными комплексами необходимо проводить при температуре 37 °C.
- Для процедуры инсеминации рекомендуется использовать капли со взвесью обработанных сперматозоидов с концентрацией подвижных форм в интервале от 0,1 до 0,5 x 106/мл. На одну яйцеклетку должно приходиться от 10 до 50 тысяч сперматозоидов [132].
Уровень доказательности 4C.
- Рекомендуется проводить совместное культивирование ооцитов и сперматозоидов в течение 3 часов ("короткая инкубация"), хотя допускается традиционный вариант длительной инкубации (16 - 20 часов) [131], [133].
Уровень доказательности 1A.
- Рекомендуется проводить оценку оплодотворения (подсчет пронуклеусов в каждой зиготе) через 16 - 20 часов после инсеминации [132].
Уровень доказательности 1A.
Комментарии:
при проведении оплодотворения традиционным методом ЭКО клетки кумулюса необходимо предварительно очистить для лучшей визуализации пронуклеусов;
оценка оплодотворения и качества эмбрионов должна проводиться на инвертированном микроскопе или эквивалентной оптике при высоком увеличении (рекомендованное минимальное увеличение - 200x; более предпочтительное увеличение - 400x);
при проведении оценки качества эмбрионов на стадии дробления необходимо учитывать число бластомеров, их размер и симметричность, процент фрагментации эмбриона, наличие цитоплазматических аномалий (грануляция, вакуолизация и мультинуклеация в бластомерах эмбриона);
оценка качества на стадии бластоцисты включает оценку размера кавитации бластоцели, количества клеток трофэктодермы (ТФЭ) и внутриклеточной массы (ВКМ) [131].
- Рекомендуется проводить культивирование в инкубаторе при низких концентрациях кислорода, так как это влияет на увеличение частоты рождения [103].
Уровень доказательности 4A.
Комментарий:
результаты многих исследований демонстрируют убедительные данные увеличения частоты рождаемости при культивировании в инкубаторах со сниженным содержанием кислорода (5 - 7%) по сравнению со стандартным культивированием (21%).
11.6.2. Инъекция сперматозоида в цитоплазму яйцеклетки (метод ИКСИ)
ИКСИ - инъекция сперматозоида в цитоплазму яйцеклетки является вариантом экстракорпорального оплодотворения, которое достигается путем введения одного сперматозоида в ооцит с помощью специальных микроинструментов. Сперматозоид отбирается эмбриологом из множества других в обработанной сперме на основании нескольких параметров: степень подвижности и морфология, однако могут использоваться и другие характеристики (поверхностный электрический заряд мембраны, способность связываться с гиалуроновой кислотой, экспрессия маркеров апоптоза, оценка морфологии под большим увеличением).
Метод ИКСИ рекомендован при [126], [127], [128], [129], [134], [135], [136]:
- мужском факторе бесплодия, который проявляется в значительном снижении параметров эякулята;
- при использовании сперматозоидов, полученных хирургическим путем;
- при использовании ооцитов после криоконсервации;
- при проведении ПГТ методом ПЦР;
- при низкой частоте оплодотворения в предыдущей программе ЭКО.
Уровень доказательности 4C.
- Необходимость проведения метода ИКСИ для ПГТ, включающего этап полногеномной амплификации (a-CGH, NGS), остается спорным вопросом [137], [138], [139].
Уровень доказательности 4C.
- Метод ИКСИ не дает преимуществ при бесплодии неясного генеза, при позднем репродуктивном возрасте женщины (старше 35 лет), при малом числе полученных ооцитов (менее 4 - 6) и при низком качестве ооцитов, если другие показания для ИКСИ отсутствуют [140], [141], [142], [143], [144].
- При подготовке к ИКСИ рекомендуется проводить денудацию ооцитов ближе к моменту оплодотворения [132].
Уровень доказательности 4C.
Комментарии:
ИКСИ рекомендуется проводить только по итогам на стадии MII (метафаза II);
ИКСИ следует проводить в условиях, близких к оптимальным: температура 37 °C, время нахождения ооцитов вне инкубатора не более 10 мин;
при удалении кумулюсных клеток с ооцитов концентрация гиалуронидазы и ее воздействие должны быть сведены к минимуму [131];
чтобы предотвратить повреждение ооцитов, следует использовать пипетки с соответствующим диаметром и необходимо избегать интенсивного пипетирования;
рекомендуется выбирать морфологически нормальный, подвижный сперматозоид;
необходимо оценить качество ооцитов: гигантские ооциты и ооциты с гигантским полярным тельцем не рекомендуется оплодотворять.
11.6.3. Метод ИМСИ
ИМСИ - инъекция морфологически нормального сперматозоида в цитоплазму яйцеклетки (intracytoplasmic morphologically selected sperm injection). Метод заключается в отборе сперматозоида для ИКСИ при большом увеличении (6000x и более).
- На данный момент рутинное назначение метода ИМСИ не рекомендовано для клинического применения [145].
Уровень доказательности 1A.
Комментарии:
нет исследований, которые показывают положительное влияние данной методики на частоту рождения и снижение частоты прерывания беременности;
результаты систематического обзора и мета-анализа 2013 года не поддерживают рутинное применение ИМСИ;
необходимы дальнейшие исследования с доказательствами высокого качества для рекомендации клинического использования ИМСИ.
11.6.4. Метод ПИКСИ
ПИКСИ - инъекция физиологически нормального сперматозоида в цитоплазму яйцеклетки (physiologic intracytoplasmic sperm injection). Это метод отбора сперматозоидов для ИКСИ, основанный на их способности связываться с гиалуроновой кислотой.
- На данный момент рутинное назначение метода ПИКСИ не рекомендовано для клинического применения [146].
Уровень доказательности 1A.
Комментарии:
метод ПИКСИ основан на свойстве сперматозоида с полным созреванием ДНК прикрепляться к гиалуроновой кислоте;
систематический обзор и мета-анализ 2014 года не выявил достаточных доказательств, подтверждающих преимущество ПИКСИ перед стандартным ИКСИ в отношении частоты наступления беременности и живорождения;
необходимы дальнейшие клинические исследования для рекомендации внедрения ПИКСИ в рутинную практику.
11.6.5. Вспомогательный хетчинг
Вспомогательный хетчинг - микроманипуляция, заключающаяся в рассечении блестящей оболочки ооцита или эмбриона с целью получения материала для проведения ПГТ или для облегчения вылупления эмбриона. Существует несколько видов вспомогательного хетчинга: химический, лазерный, механический, ферментативный. Выбор методики зависит от возможностей и оснащения лаборатории.
Показаниями к вспомогательному хетчингу являются [147], [148], [149], [150]:
- изменение морфологии блестящей оболочки эмбриона;
- перенос размороженных эмбрионов;
- необходимость биопсии эмбриона для проведения ПГТ;
- плохой прогноз (предыдущие неудачные попытки ЭКО, эмбрионы низкого качества).
Уровень доказательности 1A.
- Не рекомендуется рутинное применения вспомогательного хетчинга для всех групп пациентов без наличия показаний [151], [152].
Уровень доказательности 1A.
Комментарии:
выбор оптимального метода проведения вспомогательного хетчинга (лазерный или ферментативный) определяется на усмотрение клиники;
в случае использования лазерного вспомогательного хетчинга рекомендуется делать отверстие в блестящей оболочке, соответствующее четверти диаметра, и проводить его в той части блестящей оболочки, которая наиболее удалена от клеток эмбриона во избежание теплового воздействия на клетки.
11.6.6. Биопсия бластомеров и трофэктодермы
Биопсия эмбрионов является безопасной процедурой, позволяющей провести ПГТ. Достоверность результатов ПГТ напрямую зависит от качества предоставленного материала, поэтому в эмбриологических лабораториях особое внимание уделяется мерам для снижения риска контаминации тестируемых образцов.
- Процедуру биопсии бластомеров проводят на 3-й день развития эмбрионов.
Рекомендуется забирать не более одного бластомера от каждого эмбриона.
Уровень доказательности 1A.
Комментарии:
забор большего числа клеток может негативно влиять на жизнеспособность и имплантационный потенциал эмбриона;
для анализа рекомендуется забирать бластомер среднего размера с четко визуализируемым одним ядром [153], [154], [155].
- Процедуру биопсии трофэктодермы рекомендуется проводить на 5-й и 6-й день развития на бластоцистах отличного и хорошего качества (не менее ЗВВ по классификации Гарднера) [156]
Уровень доказательности 4C.
Комментарии:
эмбрионы плохого качества рекомендуется биопсировать после обсуждения с пациентами всех возможных рисков проведения подобной манипуляции и последующей криоконсервации;
в особых случаях возможна биопсия остановившихся в развитии эмбрионов, диагностируемых с целью уточнения причины остановки в развитии;
при биопсии ТФЭ для генетического тестирования рекомендуется забирать не более пяти клеток с минимальным возможным их повреждением;
не рекомендуется при биопсии ТФЭ забирать клетки, не включенные в состав бластоцисты, для снижения частоты ложноположительных результатов ПГТ;
для проведения биопсии ТФЭ рекомендуется использовать флип-метод (механическое обрывание части ТФЭ с помощью плотной стыковки удерживающей и биопсийной иглы), допускается не более двух выстрелов лазера для облегчения разрыва контактов между клетками ТФЭ.
в случае использования лазерной биопсии не рекомендуется использовать лазер вблизи ВКМ эмбриона, а также рекомендуется делать выстрелы в область межклеточных контактов с целью минимизации повреждения клеток ТФЭ [157];
подготовку и хранение проб биоптата необходимо осуществлять согласно рекомендациям генетической лаборатории с использованием предоставленного генетической лабораторией буфера и учетом конкретного метода тестирования.
11.7. Программы криоконсервации гамет, эмбрионов и тканей репродуктивных органов
Программы криоконсервации ооцитов и эмбрионов является неотъемлемой частью оказания услуг с применением ВРТ. Эти программы включают в себя несколько этапов:
- криоконсервация - замораживание биологического материала;
- хранение;
- размораживание;
- проведение процедур (оплодотворение для яйцеклеток, перенос в полость матки для эмбрионов);
- поддержка лютеиновой фазы;
- диагностика беременности.
Программы криоконсервации позволяют увеличить безопасность и эффективность лечения бесплодия, повышая шансы наступления беременности благодаря кумулятивному эффекту. Криоконсервация тканей репродуктивных органов является одним из вариантов сохранения репродуктивной функции у онкологических больных.
Показаниями для криоконсервации биоматериалов являются:
- необходимость хранения половых клеток, эмбрионов и/или тканей репродуктивных органов с целью дальнейшего использования при лечении бесплодия с применением ВРТ;
- необходимость хранения половых клеток, эмбрионов и/или тканей репродуктивных органов до начала проведения химиотерапии и/или лучевой терапии у онкологических больных;
- необходимость хранения донорских половых клеток для использования при лечении бесплодия в программах ВРТ;
- хранение половых клеток, эмбрионов и/или тканей репродуктивных органов по желанию пациента, в том числе в случае "отложенного материнства".
Материал для криоконсервации
- Криоконсервацию сперматозоидов рекомендуется производить спустя 15 дней после приема антибиотиков и через 72 дня после окончания гормональной терапии, в случае, если таковые проводились.
- При криоконсервации тканей яичка или придатка яичка замораживание рекомендовано при наличии в них хотя бы одного подвижного сперматозоида в пяти полях зрения для последующего их использования в программе ИКСИ.
- Криоконсервацию ооцитов рекомендуется проводить не позже, чем через 120 минут после получения при трансвагинальной пункции фолликулов [158], [159].
Уровень доказательности 1A.
- Препарирование и криоконсервация овариальной ткани рекомендуется осуществлять немедленно после экстирпации яичника, материал должен быть доставлен в лабораторию ЭКО в асептических условиях при температуре 36,6 - 37,2 °C.
- Криоконсервацию эмбрионов рекомендуется проводить пациентам в случае, если после переноса остались эмбрионы отличного и хорошего качества [160], [161].
Уровень доказательности 1A.
Комментарий:
при криоконсервации бластоцист, полностью покинувших блестящую оболочку, рекомендуется их предварительно коллапсировать во избежание возможной травматизации эмбриона.
Методики криоконсервации
- Ооциты и эмбрионы на разных стадиях развития рекомендуется криоконсервировать методом витрификации [162].
Уровень доказательности 1A.
- Для овариальной ткани подходит как медленный протокол замораживания, так и витрификация [163], [164].
Уровень доказательности 1A.
- Для сперматозоидов, тканей яичка и придатка яичка медленный протокол замораживания является методом выбора, однако витрификация может быть альтернативой [165], [166], [167].
Уровень доказательности 2B.
Условия хранения
- Хранение криоконсервированных гамет, эмбрионов и тканей репродуктивных органов осуществляется в жидком азоте или в его парах.
- Маркировка носителей и контейнеров с криоконсервированным материалом должна содержать следующие данные: ФИО, дата криоконсервации, номер карты или другой внутренний идентификационный номер. В случае криоконсервации ооцитов/эмбрионов, необходимо указать количество ооцитов/эмбрионов на каждом крионосителе.
- Для предотвращения кросс-контаминации биологического материала, материал пациентов с гемоконтактными инфекциями рекомендовано криоконсервировать в закрытых носителях и хранить в отдельном сосуде Дьюара.
- Медицинская организация несет ответственность за соблюдение условий криоконсервации и хранения гамет, эмбрионов и тканей репродуктивных органов пациентов.
11.8. Преимплантационное генетическое тестирование
Термин преимплантационное генетическое тестирование (ПГТ/PGT - Preimplantation Genetic Testing) объединяет все виды анализа наследственного материала ооцитов (полярных тел) и эмбрионов (биопсия клеток на стадии дробления или бластоцисты), проводящиеся до момента имплантации в стенку матки, для выявления потенциальных аномалий или HLA-типирования. Он объединяет следующие группы исследований:
- ПГТ-А/PGT-A - все тесты, направленные на определение количественных хромосомных изменений (анеуплоидий),
- ПГТ-М/PGT-M - все тесты, направленные на диагностику моногенных заболеваний и выявления отдельных генных аллелей,
ПГТ-СП/PGT-SR - все тесты, направленные на выявление структурных хромосомных перестроек [168].
Решение о проведении ПГТ является добровольным, исследование проводится только с информированного согласия пациентов после консультации врача-акушера-гинеколога и врача-генетика. Проведение ПГТ-А показано:
- женщинам позднего репродуктивного возраста - 35 лет и старше;
- при привычном выкидыше (2 и более самопроизвольных прерываний беременности в анамнезе),
- при повторных неудачных попытках переноса "свежих" или размороженных эмбрионов (3-х у женщин моложе 35 лет, 2-х - у женщин 35 лет и старше),
- при тяжелых нарушениях сперматогенеза у мужчин (олигоастенотератозооспермия, олигозооспермия, азооспермия - по заключению врача-уролога).
Проведение ПГТ-М и ПГТ-СП показано [41]:
- носителям генных мутаций, сцепленных с X-хромосомой;
- при высоком риске рождения детей с наследственными заболеваниями;
- носителям генных мутаций, вызывающие моногенные заболевания: аутосомно-рецессивные, аутосомно-доминантные, имеющие высокий риск передачи наследственной патологии потомству;
- носителям хромосомных аномалий: числовых и структурных аберраций хромосом;
- носителям генных мутаций, сцепленных с Y-хромосомой;
- носителям генных мутаций, значительно повышающих риск развития онкологических заболеваний и болезней с поздней манифестацией;
- носителям наследственных гематологических заболеваний;
- женщинам с носительством мутаций мтДНК, имеющим высокий риск тяжелого течения митохондриальной болезни у потомства;
- семьям, в которых есть ребенок больной спорадическим гематологическим заболеванием, нуждающийся в пересадке донорских стволовых гемопоэтических клеток для продолжения жизни.
Уровень доказательности 4C.
Для выполнения ПГТ могут быть использованы следующие технологические платформы и лабораторные методы исследования с учетом их возможностей и ограничений [169], [170], [171]:
- мультиплексная или гнездовая полимеразная цепная реакция (ПЦР) с последующим капиллярным секвенированием или электрофорезом;
- флуоресцентная гибридизация in situ (FISH);
- сравнительная геномная гибридизация на микроматрицах (a-CGH), микроматричный анализ однонуклеотидного полиморфизма (SNP array);
- высокопроизводительное секвенирование (NGS).
Тактика ПГТ в лаборатории ВРТ определяется на основе метода лабораторного генетического исследования и основывается на следующих рекомендациях [170]:
- применение ИКСИ не является обязательным условием ПГТ, однако в случае применения ЭКО без ИКСИ генетическая лаборатория должна знать об этом;
- необходимо применять рекомендованные генетической лабораторией методы снижения риска контаминации образца посторонней ДНК;
- приоритетами при выборе метода биопсии должны являться, в первую очередь, уменьшение травматичности процедуры и, во вторую, - увеличение информативности анализа с использованием получаемого биоматериала;
- Оптимальное число клеток трофэктодермы в биоптате - 5.
Уровень доказательности 3C.
12. Осложнения в программах ВРТ
К возможным осложнениям в программах ВРТ относятся:
- многоплодная беременность;
- синдром гиперстимуляции яичников;
- внематочная и гетеротопическая беременность;
- кровотечения, связанные с пункцией фолликулов яичников;
- аллергические реакции на применяемые препараты;
- перекрут яичника;
- инфекционные осложнения.
12.1 Многоплодная беременность (МКБ-10/O30).
Определение
Многоплодная беременность - беременность несколькими плодами.
Этиология
Высокая частота многоплодных беременностей является следствием переноса нескольких эмбрионов в программах ВРТ. Также многоплодие может быть следствием естественно наступившей беременности, или возникнуть при переносе одного эмбриона в программах ВРТ в результате его разделения после переноса в полость матки (однояйцевые близнецы).
Эпидемиология
Распространенность в программах ВРТ - 20 - 25%, из них 22% - двойни, 3% - тройни [43].
Профилактика
С целью профилактики многоплодной беременности рекомендуется селективный перенос 1 эмбриона в полость матки [43], [172].
12.2 Гиперстимуляция яичников (МКБ-10/N98.1).
Определение
Синдром гиперстимуляции яичников - это чрезмерный системный ответ на стимуляцию яичников, характеризующийся широким спектром клинических и лабораторных проявлений. Может быть классифицирован как легкий, умеренный или тяжелый, в соответствии со степенью напряженности асцита, увеличения яичников и дыхательных, гемодинамических и метаболических осложнений.
Этиология и патогенез
В основе заболевания лежит повышение проницаемости стенок капилляров, что приводит к выходу внутрисосудистой жидкости во внесосудистое пространство, гемоконцентрация и развитие полиорганной недостаточности при тяжелом течении [173].
Эпидемиология
Распространенность умеренных и тяжелых форм составляет от 1% до 5% всех программ ВРТ [174].
Факторы риска [108], [78]:
- СГЯ в анамнезе;
- СПКЯ, мультифолликулярные яичники;
- возраст < 30 лет;
- астеническое телосложение (ИМТ < 18,5 кг/м2);
- наличие > 20 антральных фолликулов в обоих яичниках по данным УЗИ;
- уровень в крови АМГ > 3,4 нг/мл;
- многоплодная беременность в анамнезе.
Комментарий:
данные о диагностике и принципах лечения представлены в клинических рекомендациях, утвержденных Министерством здравоохранения РФ [173].
Профилактика СГЯ
- Рекомендуется проводить оценку факторов риска [78], [173].
Уровень доказательности 2B.
- При наличии факторов риска рекомендуется выбирать протокол овариальной стимуляции с антГнРГ [78], [173].
Уровень доказательности 1A.
- У пациенток с избыточным овариальным резервом при риске СГЯ рекомендуется использовать низкие стартовые дозы гонадотропинов и проведение протоколов с назначением антиэстрогенов [173], [175].
Уровень доказательности 1A.
- При риске развития СГЯ рекомендуется в качестве триггера финального созревания ооцитов использовать аГнРГ [78], [173], [176].
Уровень доказательности 1A.
- При риске развития СГЯ рекомендуется отмена ПЭ в данном лечебном цикле, криоконсервация эмбрионов (сегментация цикла) [78], [173].
Уровень доказательности 2B.
- С целью профилактики СГЯ возможно назначение агонистов дофамина в день введения триггера овуляции ХГЧ и в течение нескольких дней после [78], [173], [177], [178], [179].
Уровень доказательности 1A.
- С целью профилактики СГЯ рекомендуется назначение антГнРГ в день введения триггера овуляции и по показаниям в течение нескольких дней после [173].
Уровень доказательности 4C.
12.3 Внематочная беременность
Определение
К внематочной беременности относятся случаи имплантации и развития плодного яйца вне полости матки: в маточной трубе, яичнике, брюшной полости, шейке матки. Возможно сочетание разных локализаций плодных яиц, например, в полости матки и маточной трубе - гетеротопическая беременность.
Эпидемиология
Распространенность эктопической беременности в программах ВРТ составляет около 2,5%, что сопоставимо с частотой эктопических беременностей после естественного зачатия в общей популяции женщин (1 - 2%) [174]. Частота встречаемости различных локализаций внематочной беременности составляет: трубной - 90 - 95% (из них ампулярной - 80%, интерстициальной - 5 - 10%, истмической - 2,5%), яичниковой - 0,2 - 3,0%, абдоминальной - 1,3%, шеечной - 0,15%, гетеротопической - 0,8% [180].
Факторы риска внематочной беременности
- Группу риска по развитию внематочной беременности составляют пациентки, имеющие в анамнезе: ВЗОМТ, операции на маточных трубах, эндометриоз, родоразрешение путем кесарева сечения, а также курящие женщины [181], [182], [183], [184].
- Факторами риска, связанными с применением ВРТ, являются: большой объем среды в катетере для переноса эмбрионов, перенос эмбрионов близко ко дну матки, перенос > 1 эмбриона [185], [186], [187].
12.4 Кровотечения, связанные с выполнением пункции фолликулов яичников
Эпидемиология
Распространенность составляет около 0,14% [174]. Наиболее частым осложнением является незначительное наружное кровотечение из стенки влагалища в месте прокола, которое, по данным разных авторов, встречается в 0,4 - 8,6% случаев [188], [189], [190]. Внутрибрюшное кровотечение является серьезным, угрожающим жизни состоянием, возникает из-за травмы сосудов яичника или ранения крупных сосудов. Встречается с частотой от 0,03 до 0,5% [190], [191], [192].
Факторы риска кровотечений
- врожденный дефицит факторов свертывания крови;
- гипокоагуляция;
- прием антикоагулянтов;
- аспирация большого числа фолликулов;
- нарушение техники выполнения пункции фолликулов.
Профилактика кровотечений
- С целью профилактики кровотечений в программах ВРТ рекомендуется диагностика, и коррекция нарушений в свертывающей системе крове на этапе подготовки к лечебному циклу [192].
Уровень доказательности 2B.
- С целью профилактики кровотечений, связанных с пункцией яичников, рекомендуется во время данной процедуры проводить минимальное количество проколов стенки влагалища и яичника, а также выполнять тщательный ультразвуковой контроль, использовать цветное допплеровское картирования для лучшей визуализации сосудов [191], [192].
Уровень доказательности 2B.
- Для снижения риска влагалищного кровотечения и выраженности болевых ощущений, связанных с пункцией, рекомендуется использовать тонкие аспирационные иглы [88].
Уровень доказательности 1A.
- При возникновении внутрибрюшного кровотечения рекомендуется госпитализация и оперативное лечение (предпочтительно лапароскопическим доступом), путем электрокоагуляции кровоточащих сосудов и использование средств, способствующих повышению свертываемости крови внутривенно и местно [190].
Уровень доказательности 2B.
Комментарии:
консервативные мероприятия часто позволяют остановить кровотечение из яичников;
по данным литературы оперативное лечение требуется не более чем в 40 - 50% случаев всех госпитализаций по поводу внутрибрюшного кровотечения [190].
12.5 Аллергические реакции
Аллергические реакции, связанные с применением гормональных препаратов, в генерализованном виде носят казуистический характер. Относительно редко наблюдаются местные реакции в виде кратковременного покраснения, отека и зуда в области инъекции, которые не требуют лечения и отмены препарата. Сравнительно чаще встречаются местные реакции на препараты прогестерона, в связи с чем приходится изменять путь введения или переходить на аналоги.
12.6 Перекрут яичника
Эпидемиология
Перекрут яичника у пациенток, участвующих в программах ВРТ, является одним из редких осложнений 0,08 - 0,13% [193], [194]. Перекрут яичника может произойти как через 2 - 3 недели после проведения стимуляции яичников, так и в течение I и в начале II триместра беременности, наступившей после применения ВРТ.
Патогенетической основой перекрута яичника является значительное увеличение его размеров при неизменной ширине мезовариума, что способствует меньшей устойчивости яичника при вращении его вокруг своей оси. При перекруте яичника вследствие нарушения кровоснабжения (частичного или, реже, полного) возникают кровоизлияния в яичник, его отек и - как результат этого - еще большее увеличение его размеров, некроз тканей [195].
Фактором риска является гиперстимуляция яичников [194], [196], [197], [198].
Клиническая картина перекрута яичника неспецифична: резкие боли в нижних отделах живота различной интенсивности, более выраженные в одной из подвздошных областей, тошнота, рвота, повышение температуры. Патогномоничных признаков, выявляемых при УЗИ и допплерометрии нет, так как перекрут обычно не сопровождается полным блоком кровоснабжения и развитием тромбоза [199], [200], [201].
Профилактика
- С целью профилактики перекрута яичника рекомендуется предупреждать развитие СГЯ [194], [196], [197].
Уровень доказательности 4C.
- С целью профилактики перекрута яичника рекомендуется аспирация максимального количества фолликулов при пункции фолликулов [191].
Уровень доказательности 4C.
- Подозрение на перекрут яичника является показанием для диагностической лапароскопии. При отсутствии некроза допустимо раскручивание ножки и сохранение яичника [191], [195], [200].
Уровень доказательности 4C.
12.7 Инфекционные осложнения
Инфекционные осложнения (обострение хронического воспаления придатков матки, пельвиоперитонит и др.) в программах ВРТ чаще всего ассоциируются с пункцией фолликулов яичника [191].
Эпидемиология
Распространенность составляет 0,02 - 1,5% [202].
- С целью профилактики инфекционных осложнений рекомендуется проводить процедуры ВРТ только при наличии "действующих" результатов исследований на инфекции (нормальный биоциноз влагалища и цервикального канала) и отсутствии признаков воспаления; неукоснительное соблюдение правил асептики и антисептики [191], [202].
Уровень доказательности 4C.
- С целью профилактики инфекционных осложнений рекомендуется проводить минимальное количество проколов стенки влагалища и яичника во время пункции фолликулов яичников [191], [192].
Уровень доказательности 2B.
- Рутинное назначение антибактериальных препаратов после пункции яичников не рекомендуется [203].
Уровень доказательности 4C.
- Профилактическое введение антибактериальных препаратов при пункции фолликулов яичника рекомендовано пациенткам из группы риска по развитию инфекционных осложнений (воспалительные заболевания органов малого таза в анамнезе, эндометриоз, спаечный процесс в малом тазу после хирургических операций) [192], [203].
Уровень доказательности 4C.
Комментарий:
при возникновении инфекционных осложнений рекомендуется отмена ПЭ в данном лечебном цикле, криоконсервация эмбрионов (сегментация цикла).
13. Донорство гамет и эмбрионов
Донорство ооцитов осуществляется при наличии информированного добровольного согласия женщины-донора. Донорство может быть анонимным, при котором персональные данные донора неизвестны реципиенту, или неанонимным.
- В программах ВРТ могут использоваться как свежие, так и замороженные донорские ооциты. Прогноз считается оптимистичным при использовании (размораживании) не менее 9 витрифицированных ооцитов [159].
Уровень доказательности 4C.
- Требования, предъявляемые к донорам ооцитов: лица в возрасте от 18 до 35 лет; физическое и психическое здоровые; прошедшие медико-генетическое консультирование.
Комментарии:
противопоказаниями к участию в программе "Донорство ооцитов" (для донора) являются: признаки или повышенный риск наличия ВИЧ-инфекции, ИППП или других заболеваний, которые могут быть причиной инфицирования реципиента; носительство хромосомной патологии; наличие детей с врожденной патологией; привычное невынашивание беременности; онкологические заболевания; эндокринные нарушения;
доказанная фертильность донора желательна, но не обязательна [204].
- Обследование доноров ооцитов проводится так же, как и для пациенток программ ВРТ.
- Дополнительными обязательными обследованиями являются: кариотипирование (однократно); медико-генетическое консультирование (однократно); справка из психоневрологического диспансера (срок годности справки - 1 год); справка из наркологического диспансера (срок годности справки - 1 год); молекулярно-биологическое исследование крови на ВИЧ-1 совместно с определением антител классов M, G к ВИЧ-1,2 и Agp24/25; молекулярно-биологическое исследование крови на HBV-инфекцию и HCV-инфекцию совместно с определением антител классов M, G к вирусам гепатита B и C (срок годности исследования - 3 месяца).
Комментарий:
согласно пунктам 8.4.2.3., 8.4.2.7. и 8.4.4.1 санитарно-эпидемиологических правил СП 3.1.5.2826-10 "Профилактика ВИЧ-инфекции", необходимо параллельно проводить молекулярно-биологические исследования (ПЦР, NAT) и иммунологические исследования (ИФА, ИХЛА) на маркеры ВИЧ, вируса гепатита B, вируса гепатита C для профилактики инфицирования гемотрансмиссивными инфекциями при переливании донорской крови и ее компонентов, пересадке органов и тканей и при искусственном оплодотворении".
- Овариальная стимуляция у доноров ооцитов - такая же как в программах ЭКО и ИКСИ.
- Рекомендуется информировать доноров ооцитов о возможных осложнениях овариальной стимуляции и пункции фолликулов яичников [108].
Уровень доказательности 4C.
Донорство спермы осуществляется при наличии информированного добровольного согласия мужчины-донора. Донорство может быть анонимным, при котором персональные данные донора неизвестны реципиенту или неанонимным.
- Требования, предъявляемые к донорам спермы: лица в возрасте от 18 до 35 лет; физическое и психическое здоровые, включая нормальные показатели спермограммы; прошедшие медико-генетическое консультирование.
Комментарии:
противопоказаниями к участию в программе "Донорство спермы" (для донора) являются: признаки или повышенный риск наличия ВИЧ-инфекции, ИППП или других заболеваний, которые могут быть причиной инфицирования реципиента; носителъство хромосомной патологии; наличие детей с врожденной патологией;
доказанная фертильность донора желательна, но не обязательна [204].
- Обследование доноров спермы проводится так же, как и для пациентов программ ВРТ.
- Дополнительное обследование доноров спермы включает: консультацию врача-уролога (срок годности консультации - 1 год); консультацию врача-терапевта (срок годности консультации - 1 год); спермограмму (перед началом программы донорства спермы); кариотипирование (однократно); медико-генетическое консультирование (однократно); определение группы крови и резус-фактора (однократно); справка из психоневрологического диспансера (срок годности справки - 1 год); справка из наркологического диспансера (срок годности справки - 1 год); молекулярно-биологическое исследование крови на ВИЧ-1 совместно с определением антител классов M, G к ВИЧ-1,2 и Agp24/25 (срок годности исследования - 3 месяца); молекулярно-биологическое исследование крови на HBV-инфекцию и HCV-инфекцию совместно с определением антител классов M, G к вирусам гепатита В и С (срок годности исследования - 3 месяца).
Комментарии:
согласно пунктам 8.4.2.3., 8.4.2.7. и 8.4.4.1 санитарно-эпидемиологических правил СП 3.1.5.2826-10 "Профилактика ВИЧ инфекции", необходимо параллельно проводить молекулярно-биологические исследования (ПЦР, NAT) и иммунологические исследования (ИФА, ИХЛА) на маркеры ВИЧ, вируса гепатита В, вируса гепатита С для профилактики инфицирования гемотрансмиссивными инфекциями при переливании донорской крови и ее компонентов, пересадке органов и тканей и при искусственном оплодотворении".
- Разрешается применение только криоконсервированной донорской спермы после получения повторных (через 6 месяцев после криоконсервации) отрицательных результатов обследования донора на определение иммуноглобулинов класса M и G к ВИЧ 1,2 и Agp24/25, и молекулярно-биологического исследования крови на ВИЧ-1, иммуноглобулинов класса M и G к вирусам гепатита B и C, и молекулярно-биологического исследования крови на HBV-инфекцию и HCV-инфекцию, иммуноглобулинов класса M и G к Treponema pallidum в крови.
Комментарии:
рекомендовано оценить несколько образцов спермы, полученной после 2 - 5 дней воздержания;
общепринятых критериев оценки образцов спермы для отбора кандидатов в доноры спермы не существует, они могут отличаться в разных лабораториях, минимальными нормальными показателями спермы можно считать референсные значения, рекомендованные ВОЗ в 2010 г. [64];
Донорство эмбрионов
- Донорами эмбрионов могут быть пациенты, у которых после завершения формирования полной семьи (рождения ребенка) остаются в банке неиспользованные криоконсервированные эмбрионы. По свободному решению и письменному информированному согласию пациентов-доноров эти эмбрионы могут быть использованы для бесплодной супружеской пары/одинокой женщины (реципиентов). В этом случае врачу нужно проанализировать результаты обследования супругов на момент получения эмбрионов, оценить катамнез и принять решение о возможности донирования эмбрионов.
- Обследование доноров эмбрионов проводится также, как и для пациентов программ ВРТ.
- Передача эмбрионов учреждению должна быть оформлена документально.
- Донорские эмбрионы могут быть получены также в результате оплодотворения донорских ооцитов спермой донора.
- Критерии отбора и объем обследования доноров гамет для программы "Донорство эмбрионов": такие же, что для доноров гамет.
14. Сохранение репродуктивной функции у онкологических пациентов
Пациенты с онкологической патологией должны быть предупреждены о высокой вероятности потери репродуктивной функции после оперативного лечения основного заболевания, химио- и/или лучевой терапии. Повреждающее действие на половые клетки препаратов усиливается с возрастом пациентов.
На момент постановки диагноза онкологического заболевания онколог должен обсудить с пациентом влияние злокачественного новообразования и его лечения на репродуктивную функцию.
Рассматривая возможное назначение процедуры сохранения репродуктивной функции пациентам, у которых диагностировано злокачественное новообразование, необходимо учитывать следующие факторы:
- диагноз;
- план лечения;
- прогноз излечения злокачественного новообразования;
- прогноз перспективности получения генетического материала исходя из возраста пациентки и состояния овариального резерва;
- определение способа получения и консервации генетического материала;
- оценка физического состояния пациентов, позволяющее провести овариальную стимуляцию и отбор яйцеклеток;
- проведение протокола овариальной стимуляции не должно отодвигать начало курса лечения основного заболевания.
С целью сохранения репродуктивной функции мужчины проводится:
- криоконсервация спермы, полученной путем маструбации;
- криоконсервация спермы, полученной оперативным путем;
- криоконсервация тестикулярной ткани.
С целью сохранения репродуктивной функции женщины проводится:
- криоконсервация ооцитов;
- криоконсервация эмбрионов;
- криоконсервация ткани яичника.
Криоконсервация проводится в клинике ВРТ.
Пациенткам с сопутствующей онкологической патологией в зависимости от ситуации могут быть рекомендованы следующие протоколы ВРТ:
- программы ВРТ в естественном цикле или модифицированном естественном цикле;
- протоколы овариальной стимуляции с антГнРГ [205], [206];
- программа "ЭКО и ИКСИ с созреванием ооцитов in vitro" [207], [208];
- двойной протокол овариальной стимуляции.
- В качестве триггера финального созревания ооцитов у пациенток с онкологической патологией рекомендуется использование аГнРГ [206], [209].
Уровень доказательности 4C.
- После проведения трансвагинальной пункции, с целью защиты яичников от повреждающего воздействия химиотерапевтических препаратов, показано введение аГнРГ на 3 - 6 месяцев.
Комментарии:
выжидательная тактика ведения возможна после прекращения терапии основного заболевания и наступления ремиссии;
период стойкой ремиссии, после консультации онколога, возможен перенос криоконсервированных эмбрионов в полость матки пациентки в естественном или стимулированном цикле;
программа суррогатного материнства осуществляется при наличии противопоказаний для вынашивания беременности.
15. Бесплодие в супружеских парах с ВИЧ-инфекцией
Инфицирование ВИЧ не является противопоказанием к оказанию пациентам медицинской помощи с использованием ВРТ и ИИ. Нуждаться в этих видах помощи могут конкордантные пары (оба супруга - носители инфекции) и дискордантные пары (носитель - один из партнеров).
ВИЧ-инфицированные пациенты с позиции показаний к применению репродуктивных технологий могут быть разделены на 2 группы:
- Пациенты с нормальным фертильным статусом (не имеют патологии, ассоциированной с бесплодием). Это дискордантные супружеские пары, которые предохраняются при половой жизни с целью профилактики инфицирования ВИЧ-негативного партнера.
- Конкордантные и дискордантные супружеские пары, у которых имеется бесплодие.
Выбор программы безопасного (в том числе для будущего ребенка) варианта достижения беременности должен осуществляться специалистом ВРТ ex consilio с лечащим врачом-инфекционистом с информированием пациентов о возможных рисках передачи инфекции.
Обследование пациентов и проведение программ ВРТ или ИИ возможно только при наличии заключения из Центра по профилактике и борьбе со СПИДом и инфекционными заболеваниями (учреждения, в котором пациенты состоят на учете). Заключение должно содержать краткую выписку из истории болезни и диагноз, результаты анализов, указание на отсутствие противопоказаний и особые условия (например, параллельное проведение антиретровирусной терапии) к оказанию данного вида медицинской помощи и вынашиванию беременности.
Проведение ВРТ в супружеских парах с ВИЧ-инфекцией у мужчины
- Современная антиретровирусная терапия (АТР) позволяет снизить вирусную нагрузку в крови до так называемого "не определяемого уровня" (менее 50 копий/мл). Сохранение этого уровня при ежемесячном контроле в течение 6 месяцев, в соответствии с некоторыми зарубежными рекомендациями, рассматривается, как основание считать мужчину не опасным в контагиозном отношении, что в свою очередь является достаточным для разрешения на незащищенные половые акты в переовуляторный период с целью достижения беременности естественным путем [108].
- Перед проведением ВРТ назначается консультация врача-инфекциониста Центра по профилактике и борьбе со СПИД и инфекционными заболеваниями по вопросу снижения риска передачи ВИЧ-инфекции партнеру и будущему ребенку, по результатам которой оформляется выписка из медицинской документации с указанием стадии и фазы ВИЧ-инфекции, двукратных результатов лабораторного обследования в течение последних 6 месяцев (уровень лимфоцитов (СД 4+), вирусная нагрузка) и медицинского заключения о возможности проведения ВРТ в настоящее время или целесообразности отсрочить проведение ВРТ до достижения субклинической стадии заболевания, фазы ремиссии и неопределяемого уровня РНК ВИЧ.
- Проведение ВРТ возможно только при достижении неопределяемого уровня РНК ВИЧ в крови в течение 6 месяцев, документально подтвержденного в двух последовательных исследованиях.
Комментарии:
перед проведением ВРТ рекомендуется назначение АТР независимо от наличия клинических и лабораторных показаний к их назначению;
в случае отсутствия полного подавления РНК ВИЧ в ходе АТР вопрос о возможности проведении ВРТ решается врачом-инфекционистом, участвующим в системе оказания помощи ВИЧ-инфицированным пациентам.
- Перед использованием ВРТ ВИЧ-дискордантные мужчина и женщина должны использовать презерватив при каждом половом контакте в период проведения процедуры и во время беременности.
- Метод оплодотворения (ЭКО или ИКСИ) рекомендуется выбирать в зависимости от фактора бесплодия [210].
Уровень доказательности 4C.
- Культивирование гамет и эмбрионов осуществляется в отдельном инкубаторе [211].
Комментарий:
ВИЧ может содержаться в семенной плазме, в связи с чем, проведение оплодотворения методом ИКСИ снижает вероятность контаминации сперматозоидов вирусом.
Проведение ВРТ в супружеских парах с ВИЧ-инфекцией у женщины
- Перед проведением ВРТ назначается консультация врача-инфекциониста Центра по профилактике и борьбе со СПИД и инфекционными заболеваниями по вопросу снижения риска передачи ВИЧ-инфекции партнеру и будущему ребенку, по результатам которой оформляется выписка из медицинской документации с указанием стадии и фазы ВИЧ-инфекции, двукратных результатов лабораторного обследования в течение последних 6 месяцев (уровень лимфоцитов (СД 4+), вирусная нагрузка) и медицинского заключения о возможности проведения ВРТ в настоящее время или целесообразности отсрочить проведение ВРТ до достижения субклинической стадии заболевания, фазы ремиссии и неопределяемого уровня РНК ВИЧ.
- Проведение ВРТ возможно только при достижении неопределяемого уровня РНК ВИЧ в крови в течение 6 месяцев, документально подтвержденного в двух последовательных исследованиях.
Комментарии:
перед проведением ВРТ рекомендуется назначение АТР независимо от наличия клинических и лабораторных показаний к их назначению;
в случае отсутствия полного подавления РНК ВИЧ в ходе АТР вопрос о возможности проведении ВРТ решается врачом-инфекционистом, участвующим в системе оказания помощи ВИЧ-инфицированным пациентам;
инвазивные медицинские вмешательства при многоплодной беременности (редукция эмбриона, хирургическая коррекция истмико-цервикальной недостаточности и т.д.) могут привести к увеличению риска передачи ВИЧ-инфекции от матери ребенку.
- Стимуляцию яичников рекомендуется проводить по общепринятым принципам.
- Пункция фолликулов яичников и ПЭ должны проводиться в специально выделенные для этого часы (как последние в этот день манипуляций), либо в отдельных помещениях.
- Криоконсервацию эмбрионов рекомендуется осуществлять в закрытых крионосителях (не более одного эмбриона в каждом), а хранение в специально выделенном для этой группы пациентов сосуде Дьюара.
- После завершения работ должна быть проведена уборка и дезинфекция помещения и использованного оборудования [202].
Уровень доказательности 4C.
КРИТЕРИИ
ОЦЕНКИ КАЧЕСТВА МЕДИЦИНСКОЙ ПОМОЩИ, ОКАЗАННОЙ ПАЦИЕНТАМ
С БЕСПЛОДИЕМ
Критерии оценки качества медицинской помощи,
оказанной пациенткам с женским бесплодием неуточненным
(МКБ-10/N97 или N97.9)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Трансвагинальное УЗИ малого таза
|
|
|
2.
|
Оценка овуляции
|
Да/Нет
|
|
3.
|
Оценка овариального резерва (уровень ФСГ, АМГ, КАФ)
|
Да/Нет
|
|
4.
|
Оценка уровня ТТГ
|
Да/Нет
|
|
5.
|
Оценка проходимости маточных труб по данным ГСГ/ЭХО-ГСС
|
Да/Нет
|
|
6.
|
Мазок из влагалища на степень чистоты
|
Да/Нет
|
|
7.
|
Молекулярно-биологическое исследование соскоба из цервикального канала на выявление генетического материала Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis
|
Да/Нет
|
|
8.
|
Выполнение спермограммы
|
Да/Нет
|
Критерии оценки качества медицинской
помощи, оказанной пациенткам с бесплодием трубного
происхождения (МКБ-10/N97.1)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Направление в программы ВРТ при нарушении проходимости маточных труб по данным ГСГ
|
Да/Нет
|
|
2.
|
Направление на лапароскопию при наличии гидросальпинкса
|
Да/Нет
|
|
3.
|
Выполнение лапароскопии и тубэктомии при наличии гидросальпинкса
|
Да/Нет
|
|
4.
|
Выполнение морфологического (гистологического) исследования препарата иссеченной ткани (при хирургическом вмешательстве)
|
Да/Нет
|
Критерии оценки качества медицинской помощи,
оказанной пациенткам с бесплодием, связанным с отсутствием
овуляции (МКБ-10/N97.0)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Оценка уровня ПРЛ, ЛГ, ФСГ, Е2, тестестерона, ТТГ
|
Да/Нет
|
|
2.
|
Овариальная стимуляция: фармакологическая терапия у женщин с ановуляцией или олигоовуляцией с целью формирования нормальных овуляторных циклов, при условии нормозооспермии у партнера (не более 6 циклов)
|
Да/Нет
|
|
3.
|
Направление на программы ВРТ при отсутствии эффекта
|
Да/Нет
|
Критерии оценки качества медицинской помощи,
оказанной пациенткам с бесплодием маточного происхождения
(МКБ-10/N97.2), в частности связанного с врожденой
аномалией половых органов (МКБ-10/Q51)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Выполнение трансвагинального УЗИ малого таза
|
Да/Нет
|
|
2.
|
Направление на лапароскопию, гистероскопию
|
Да/Нет
|
|
3.
|
Выполнение лапароскопии, гистероскопии
|
Да/Нет
|
|
4.
|
Выполнение морфологического (гистологического) исследования препарата иссеченной ткани (при хирургическом вмешательстве)
|
Да/Нет
|
|
5.
|
Наблюдение для восстановления естественной фертильности в течение 6 мес. (при условии сохраненной овуляции, проходимых маточных трубах, нормозооспермии у партнера)
|
Да/Нет
|
|
6.
|
Направление в программы ВРТ
|
Да/Нет
|
Критерии оценки качества медицинской помощи,
оказанной пациенткам с бесплодием маточного происхождения
(МКБ-10/N97.2), в частности связанного с лейомиомой
матки (МКБ-10/D25)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Выполнение трансвагинального УЗИ малого таза или ЭХО-ГСС
|
Да/Нет
|
|
2.
|
Направление на гистерорезектоскопию для подслизистой лейомиомы матки (МКБ-10/D25.0)
|
Да/Нет
|
|
3.
|
Выполнение гистерорезектоскопии для подслизистой лейомиомы матки (МКБ-10/D25.0)
|
Да/Нет
|
|
4.
|
Направление на хирургическое лечение для субсерозной лейомиомы матки (МКБ-10/D25.2) при наличии: перешеечного узла; больших размерах узла; нарушения питания узла
|
Да/Нет
|
|
5.
|
Направление на хирургическое лечение для интрамуральной лейомиомы матки (МКБ-10/D25.1) при наличии: узла > 4 - 5 см; деформации полости матки; нарушении питания узла; безуспешных попытках ЭКО
|
Да/Нет
|
|
6.
|
Выполнение операции для интрамуральной лейомиомы матки (МКБ-10/D25.1) при наличии: узла > 4 - 5 см; деформации полости матки; нарушении питания узла; безуспешных попытках ЭКО
|
Да/Нет
|
|
7.
|
Выполнение морфологического (гистологического) исследования препарата иссеченной ткани (при хирургическом вмешательстве)
|
Да/Нет
|
|
8.
|
Направление в программы ВРТ
|
Да/Нет
|
Критерии оценки качества медицинской
помощи, оказанной пациенткам с женским бесплодием
неуточненным (МКБ-10/N97.9)
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Оценка овуляции (уровень прогестерона во 2 фазу цикла и/или УЗ мониторинг)
|
Да/Нет
|
|
2.
|
Оценка овариального резерва (уровень ФСГ, АМГ, КАФ)
|
Да/Нет
|
|
3.
|
Оценка проходимости маточных труб (ГСГ или ЭХО-ГСС)
|
Да/Нет
|
|
4.
|
Молекулярно-биологическое исследование соскоба из цервикального канала на выявление генетического материала Neisseria gonorrhoeae, Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Mycoplasma genitalium, Trichomonas vaginalis
|
Да/Нет
|
|
5.
|
Выполнение спермограммы
|
Да/Нет
|
|
6.
|
Направление в программы ВРТ
|
Да/Нет
|
Критерии оценки качества медицинской помощи, оказанной
пациентам в программах ВРТ
|
N
|
Критерии качества
|
Оценка выполнения
|
|
1.
|
Проведение предусмотренного обследования пациентов к применению программ ВРТ
|
Да/Нет
|
|
2.
|
Обоснование выбора программ ВРТ
|
Да/Нет
|
|
3.
|
УЗ мониторинг состояния эндометрия и яичников
|
Да/Нет
|
|
4.
|
Своевременное проведение пункции фолликулов яичников
|
Да/Нет
|
|
5.
|
Использование хирургических методов получения сперматозоидов (при наличии показаний)
|
Да/Нет
|
|
6.
|
Проведение программы ИКСИ (при наличии показаний)
|
Да/Нет
|
|
7.
|
Проведение биопсии бластомеров и/или трофэктодермы (при наличии показаний)
|
Да/Нет
|
|
8.
|
Перенос в полость матки не более 2 эмбрионов
|
Да/Нет
|
|
9.
|
Проведение криоконсервации гамет и эмбрионов (при наличии показаний, соответствующих объектов и информированного согласия пациентов)
|
Да/Нет
|
|
10.
|
Профилактика развития тяжелых стадий синдрома гиперстимуляции яичников
|
Да/Нет
|
|
12.
|
Проведение программ "Донорство спермы", "Донорство ооцитов", "Суррогатное материнство", "Донорство эмбрионов" (при наличии показаний)
|
Да/Нет
|
СПИСОК ЛИТЕРАТУРЫ
1. Practice Committee of American Society for Reproductive Medicine. Definitions of infertility and recurrent pregnancy loss: a committee opinion. Fertil Steril [Internet]. 2013; 99(1):63.
2. Gnoth C, Godehardt D, Godehardt E, Frank-Herrmann P, Freundl G. Time to pregnancy: results of the German prospective study and impact on the management of infertility. Hum Reprod [Internet]. 2003; 18(9):1959-66.
3. Centers for Disease Control and Prevention. Reproductive health. Infertility. [Internet].
4. Menken J, Trussell J, Larsen U. Age and infertility. Science [Internet]. 1986; 233(4771):1389-94.
5. Levitas E, Lunenfeld E, Weiss N, Friger M, Har-Vardi I, Koifman A, et al. Relationship between the duration of sexual abstinence and semen quality: analysis of 9,489 semen samples. Fertil Steril [Internet]. 2005; 83(6):1680-6.
6. Elzanaty S, Malm J, Giwercman A. Duration of sexual abstinence: epididymal and accessory sex gland secretions and their relationship to sperm motility. Hum Reprod [Internet]. 2005; 20(1):221-5.
7. Brosens I, Gordts S, Puttemans P, Campo R, Gordts S, Brosens J. Managing infertility with fertility-awareness methods. Sex Reprod Menopause [Internet]. 2006; 4(1):13-6.
8. Kutteh WH, Chao CH, Ritter JO, Byrd W. Vaginal lubricants for the infertile couple: effect on sperm activity. Int J Fertil Menopausal Stud [Internet]. 41(4):400-4.
9. Hanson MA, Bardsley A, De-Regil LM, Moore SE, Oken E, Poston L, et al. The International Federation of Gynecology and Obstetrics (FIGO) recommendations on adolescent, preconception, and maternal nutrition: "Think Nutrition First". Int J Gynaecol Obstet. 2015; 131 Suppl:S213-53.
10. Augood C, Duckitt K, Templeton AA. Smoking and female infertility: a systematic review and meta-analysis. Hum Reprod [Internet]. 1998; 13(6):1532-9.
11. Baron JA, La Vecchia C, Levi F. The antiestrogenic effect of cigarette smoking in women. Am J Obstet Gynecol [Internet]. 1990; 162(2):502-14.
12. Eggert J, Theobald H, Engfeldt P. Effects of alcohol consumption on female fertility during an 18-year period. Fertil Steril [Internet]. 2004; 81(2):379-83.
13. Jensen TK, Hjollund NH, Henriksen TB, Scheike T, Kolstad H, Giwercman A, et al. Does moderate alcohol consumption affect fertility? Follow up study among couples planning first pregnancy. BMJ. 1998; 317(7157):505-10.
14. Barratt CLR,  L, De Jonge CJ, Lamb DJ, Osorio Martini F, McLachlan R, et al. The diagnosis of male infertility: an analysis of the evidence to support the development of global WHO guidance-challenges and future research opportunities. Hum Reprod Update [Internet]. 2017; 23(6):660-80.
L, De Jonge CJ, Lamb DJ, Osorio Martini F, McLachlan R, et al. The diagnosis of male infertility: an analysis of the evidence to support the development of global WHO guidance-challenges and future research opportunities. Hum Reprod Update [Internet]. 2017; 23(6):660-80.
15. Bech BH, Obel C, Henriksen TB, Olsen J. Effect of reducing caffeine intake on birth weight and length of gestation: randomised controlled trial. BMJ [Internet]. 2007; 334(7590):409.
16. Hannuksela ML, Ellahham S. Benefits and risks of sauna bathing. Am J Med [Internet]. 2001; 110(2):118-26.
17. Povey AC, Clyma J-A, McNamee R, Moore HD, Baillie H, Pacey AA, et al. Modifiable and non-modifiable risk factors for poor semen quality: a case-referent study. Hum Reprod. 2012; 27(9):2799-806.
18. Филлипов О.С. Причины и факторы развития бесплодия среди населения Сибири. Эпидемиология и инфекционные болезни. 2002; (3):47.
19. Устинова Т.А., Артымук Н.В., Власова В.В. ПАЯ. Бесплодие в Кемеровской области. Мать и дитя в Кузбассе. 2010; 1(40):37-9.
20. Фролова Н.И., Белокриницкая Т.Е. АЛИ. Распространенность и характеристика бесплодия у женщин молодого фертильного возраста, проживающих в Забайкальском крае. Acta Biomed Sci (Бюллетень ВСНЦ СО РАМН). 2014; 4(98):54-8.
21. З.Ю. Д. Частота бесплодия в браке среди городского и сельского населения Республики Бурятия: результаты популяционного исследования. Фундаментальная и клиническая медицина. 2017; 2(4):14-21.
22. O'Flynn N. Assessment and treatment for people with fertility problems: NICE guideline. Br J Gen Pract [Internet], 2014; 64(618):50-1.
23. den Hartog JE,  SA, Land JA. Chlamydia trachomatis-associated tubal factor subfertility: Immunogenetic aspects and serological screening. Hum Reprod Update [Internet]. 12(6):719-30.
SA, Land JA. Chlamydia trachomatis-associated tubal factor subfertility: Immunogenetic aspects and serological screening. Hum Reprod Update [Internet]. 12(6):719-30.
24. Wathen NC, Perry L, Lilford RJ, Chard T. Interpretation of single progesterone measurement in diagnosis of anovulation and defective luteal phase: observations on analysis of the normal range. Br Med J (Clin Res Ed) [Internet]. 1984; 288(6410):7-9.
25. Jordan J, Craig K, Clifton DK, Soules MR. Luteal phase defect: the sensitivity and specificity of diagnostic methods in common clinical use. Fertil Steril [Internet], 1994; 62(1):54-62.
26. de Crespigny LC, O'Herlihy C, Robinson HP. Ultrasonic observation of the mechanism of human ovulation. Am J Obstet Gynecol [Internet]. 1981; 139(6):636-9.
27. Murray MJ, Meyer WR, Zaino RJ, Lessey BA, Novotny DB, Ireland K, et al. A critical analysis of the accuracy, reproducibility, and clinical utility of histologic endometrial dating in fertile women. Fertil Steril [Internet]. 2004; 81(5):1333-43.
28. Muttukrishna S, McGarrigle H, Wakim R, Khadum I, Ranieri DM, Serhal P. Antral follicle count, anti-mullerian hormone and inhibin B: predictors of ovarian response in assisted reproductive technology? BJOG [Internet]. 2005; 112(10):1384-90.
29. Broekmans FJ, Kwee J, Hendriks DJ, Mol BW, Lambalk CB. A systematic review of tests predicting ovarian reserve and IVF outcome. Hum Reprod Update [Internet], 12(6):685-718.
30. Evers JL, Slaats P, Land JA, Dumoulin JC, Dunselman GA. Elevated levels of basal estradiol-17beta predict poor response in patients with normal basal levels of follicle-stimulating hormone undergoing in vitro fertilization. Fertil Steril [Internet]. 1998; 69(6):1010-4.
31. Hendriks DJ, Mol B-WJ, Bancsi LFJMM, Te Velde ER, Broekmans FJM. Antral follicle count in the prediction of poor ovarian response and pregnancy after in vitro fertilization: a meta-analysis and comparison with basal follicle-stimulating hormone level. Fertil Steril [Internet]. 2005; 83(2):291-301.
32. Oei SG, Helmerhorst FM, Bloemenkamp KW, Hollants FA, Meerpoel DE, Keirse MJ. Effectiveness of the postcoital test: randomised controlled trial. BMJ [Internet]. 1998; 317(7157):502-5.
33. Soares SR, Barbosa dos Reis MM, Camargos AF. Diagnostic accuracy of sonohysterography, transvaginal sonography, and hysterosalpingography in patients with uterine cavity diseases. Fertil Steril [Internet]. 2000; 73(2):406-11.
34. Hamilton JA, Larson AJ, Lower AM, Hasnain S, Grudzinskas JG. Routine use of saline hysterosonography in 500 consecutive, unselected, infertile women. Hum Reprod [Internet]. 1998; 13(9):2463-73.
35. Practice Committee of the American Society for Reproductive Medicine. Committee opinion: role of tubal surgery in the era of assisted reproductive technology. Fertil Steril. 2012; 97(3):539-45.
36. Smith S, Pfeifer SM, Collins JA. Diagnosis and management of female infertility. JAMA [Internet]. 2003; 290(13):1767-70.
37. Balasch J. Investigation of the infertile couple: investigation of the infertile couple in the era of assisted reproductive technology: a time for reappraisal. Hum Reprod [Internet]. 2000; 15(11):2251-7.
38. Luttjeboer FY, Verhoeve HR, van Dessel HJ, van der Veen F, Mol BWJ, Coppus SFPJ. The value of medical history taking as risk indicator for tuboperitoneal pathology: a systematic review. BJOG [Internet]. 2009; 116(5):612-25.
39. Perquin DAM,  PJ, de Craen AJM, Helmerhorst FM. Routine use of hysterosalpingography prior to laparoscopy in the fertility workup: a multicentre randomized controlled trial. Hum Reprod [Internet]. 2006; 21(5):1227-31.
PJ, de Craen AJM, Helmerhorst FM. Routine use of hysterosalpingography prior to laparoscopy in the fertility workup: a multicentre randomized controlled trial. Hum Reprod [Internet]. 2006; 21(5):1227-31.
40. Баранов В.С., Кузнецова Т.В. Цитогенетика эмбрионального развития человека: Научно-практические аспекты. Издательст. СПб; 2006. 640 р.
41. Гинтер ЕК ПВ. Наследственные болезни. Национальное руководство. Краткое издание. ГЭОТАР-Мед. Москва; 2017. 464 р.
42. Сухих Г.Т., Назаренко Т.А., editors. Бесплодный брак. Современные подходы к диагностике и лечению. М.: ГЭОТАР-Медиа; 2010. 518 р.
43. NICE Guideline "Fertility problems: assessment and treatment". September 2017.
44. Назаренко Т.А. Стимуляция функции яичников. М.: МЕДпресс-информ; 2015. 288 p.
45. Gordon CM, Ackerman KE, Berga SL, Kaplan JR, Mastorakos G, Misra M, et al. Functional Hypothalamic Amenorrhea: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab [Internet]. 2017; 102(5):1413-39.
46. Teede HJ, Misso ML, Costello MF, Dokras A, Laven J, Moran L, et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Hum Reprod [Internet]. 2018; 33(9):1602-18.
47. European Society for Human Reproduction and Embryology (ESHRE) Guideline Group on POI, Webber L, Davies M, Anderson R, Bartlett J, Braat D, et al. ESHRE Guideline: management of women with premature ovarian insufficiency. Hum Reprod [Internet]. 2016; 31(5):926-37.
48. Melmed S, Casanueva FF, Hoffman AR, Kleinberg DL, Montori VM, Schlechte JA, et al. Diagnosis and treatment of hyperprolactinemia: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab [Internet]. 2011; 96(2):273-88.
49. Г.А. Мельниченко, Л.К. Дзеранова, Е.А. Пигарова, С.Ю. Воротникова, Л.Я. Рожинская ИИД. Федеральные клинические рекомендации по гиперпролактинемии: клиника, диагностика, дифференциальная диагностика и методы лечения. Проблемы эндокринологии. 2013; (6):19-26.
50. Кулаков В.И. Диагностика и лечение женского бесплодия. In: Кулаков В.И., Прилепская В.Н., editors. Практическая гинекология (Клинические лекции). М.: МЕДпресс-информ; 2001. p. 9-39.
51. Noventa M, Gizzo S, Saccardi C, Borgato S, Vitagliano A, Quaranta M, et al. Salpingectomy before assisted reproductive technologies: a systematic literature review. J Ovarian Res [Internet], 2016; 9(1):74.
52. Kroon B, Johnson N, Chapman M, Yazdani A, Hart R, Australasian CREI Consensus Expert Panel on Trial evidence (ACCEPT) group. Fibroids in infertility-consensus statement from ACCEPT (Australasian CREI Consensus Expert Panel on Trial evidence). Aust N Z J Obstet Gynaecol [Internet]. 2011; 51(4):289-95.
53. Yu D, Wong Y-M, Cheong Y, Xia E, Li T-C. Asherman syndrome-one century later. Fertil Steril [Internet]. 2008; 89(4):759-79.
54. Schenker JG, Margalioth EJ. Intrauterine adhesions: an updated appraisal. Fertil Steril [Internet]. 1982; 37(5):593-610.
55. March CM. Management of Asherman's syndrome. Reprod Biomed Online [Internet]. 2011; 23(1):63-76.
56. Pabuccu R, Onalan G, Kaya C, Selam B, Ceyhan T, Ornek T, et al. Efficiency and pregnancy outcome of serial intrauterine device-guided hysteroscopic adhesiolysis of intrauterine synechiae. Fertil Steril [Internet]. 2008; 90(5):1973-7.
57. Kim T, Ahn KH, Choi DS, Hwang KJ, Lee BI, Jung MH, et al. A randomized, multi-center, clinical trial to assess the efficacy and safety of alginate carboxymethylcellulose hyaluronic acid compared to carboxymethylcellulose hyaluronic acid to prevent postoperative intrauterine adhesion. J Minim Invasive Gynecol [Internet]. 19(6):731-6.
58. Pennes DR, Bowerman RA, Silver TM, Smith SJ. Failed first trimester pregnancy termination: uterine anomaly as etiologic factor. J Clin Ultrasound [Internet]. 15(3):165-70.
59. Dankert T, Vleugels M. Hysteroscopic resection of retained placental tissue: a feasibility study. Gynecol Surg [Internet]. 2008; 5(2):121-4.
60. Kodaman PH, Arid A. Intra-uterine adhesions and fertility outcome: how to optimize success? Curr Opin Obstet Gynecol [Internet]. 2007; 19(3):207-14.
61. Jungwirth A, Diemer T, Kopa Z. Male Infertility. EAU guidelines. 2016.
62. Чалый М.Е., Ахвледиани Н.Д., Харчилава Р.Р. Мужское бесплодие. Российские клинические рекомендации. Урология. 2016; (1):2-16.
63. Rowe, P. J., Comhaire, F. H., Hargreave, T. B. & Mellows HJ. WHO Manual for the Standardized Investigation, Diagnosis and Management of the Infertile Male. 2000. 102 p.
64. World Health Organization. WHO laboratory manual for the examination and processing of human semen - 5th ed. 2010. 287 p.
65. Корнеев И.А., Зассеев Р.Д., Исакова Э.В., Кинунен А.А. БНК. Оказание медицинской помощи с применением вспомогательных репродуктивных технологий у мужчин: обзор клинических рекомендаций и алгоритм маршрутизации пациентов. Проблемы репродукции. 2018; 24(4):59-65.
66. Адамян Л.В., Андреева ЕН, Аполихина И.А., Беженарь В.Ф., Геворкян М.А., Гус А.И., et al. Эндометриоз: диагностика, лечение и реабилитация. Федеральные клинические рекомендации по ведению больных. Адамян ЛВ, editor. М.; 2013. 65 p.
67. NICE Guideline "Endometriosis: diagnosis and management". September 2017.
68. Эндометриоз. Клинические рекомендации. М., 2016.
69. Dunselman GAJ, Vermeulen N, Becker C, Calhaz-Jorge C, D'Hooghe T, De Bie B, et al. ESHRE guideline: management of women with endometriosis. Hum Reprod. 2014; 29(3):400-12.
70. Practice Committee of the American Society for Reproductive Medicine. Endometriosis and infertility: a committee opinion. Fertil Steril [Internet]. 2012; 98(3):591-8.
71. Polat M,  ,
,  K,
K,  H. In vitro fertilization for endometriosis-associated infertility. Womens Health (Lond Engl) [Internet]. 2015; 11(5):633-41.
H. In vitro fertilization for endometriosis-associated infertility. Womens Health (Lond Engl) [Internet]. 2015; 11(5):633-41.
72. Somigliana E, Garcia-Velasco JA. Treatment of infertility associated with deep endometriosis: definition of therapeutic balances. Fertil Steril [Internet]. 2015; 104(4):764-70.
73. Коган Е.А., Калинина Е.А., Колотовкина А.В., Файзуллина Н.М., Адамян Л.В. Морфологический и молекулярный субстрат нарушения рецептивности эндометрия у бесплодных пациенток с наружно-генитальным эндометриозом. Акушерство и гинекология. 2014; (8):42-57.
74. Краснопольская КВ, Назаренко Т.А. Клинические аспекты лечения бесплодия в браке. М.: ГЭОТАР-Медиа; 2014. 376 p.
75. Yazdani A. Surgery or in vitro fertilization: The simplicity of this question belies its complexity. Aust N Z J Obstet Gynaecol [Internet]. 2017; 57(6):676-8.
76. Farquhar CM, Liu E, Armstrong S, Arroll N, Lensen S, Brown J. Intrauterine insemination with ovarian stimulation versus expectant management for unexplained infertility (TUI): a pragmatic, open-label, randomised, controlled, two-centre trial. Lancet (London, England) [Internet]. 2018; 391(10119):441-50.
77. Farquhar C, Rombauts L, Kremer JA, Lethaby A, Ayeleke RO. Oral contraceptive pill, progestogen or oestrogen pretreatment for ovarian stimulation protocols for women undergoing assisted reproductive techniques. Cochrane database Syst Rev. 2017; 5:CD006109.
78. Practice Committee of the American Society for Reproductive Medicine. Electronic address: [email protected], Practice Committee of the American Society for Reproductive Medicine. Prevention and treatment of moderate and severe ovarian hyperstimulation syndrome: a guideline. Fertil Steril [Internet]. 2016; 106(7):1634-47.
79. Lambalk CB, Banga FR, Huirne JA, Toftager M, Pinborg A, Homburg R, et al. GnRH antagonist versus long agonist protocols in IVF: a systematic review and meta-analysis accounting for patient type. Hum Reprod Update [Internet], 2017; 23(5):560-79.
80. Wang R, Lin S, Wang Y, Qian W, Zhou L. Comparisons of GnRH antagonist protocol versus GnRH agonist long protocol in patients with normal ovarian reserve: A systematic review and meta-analysis. PLoS One [Internet]. 2017; 12(4):e0175985.
81. Al-Inany HG, Youssef MA, Ayeleke RO, Brown J, Lam WS, Broekmans FJ. Gonadotrophin-releasing hormone antagonists for assisted reproductive technology. Cochrane database SystRev. 2016; 4:CD001750.
82. van Wely M, Kwan I, Burt AL, Thomas J, Vail A, Van der Veen F, et al. Recombinant versus urinary gonadotrophin for ovarian stimulation in assisted reproductive technology cycles. A Cochrane review. Hum Reprod Update [Internet]. 18(2):111.
83. Mochtar MH, Danhof NA, Ayeleke RO, Van der Veen F, van Wely M. Recombinant luteinizing hormone (rLH) and recombinant follicle stimulating hormone (rFSH) for ovarian stimulation in IVF/ICSI cycles. Cochrane database Syst Rev. 2017; 5:CD005070.
84. Lensen SF, Wilkinson J, Leijdekkers JA, La Marca A, Mol BWJ, Marjoribanks J, et al. Individualised gonadotropin dose selection using markers of ovarian reserve for women undergoing in vitro fertilisation plus intracytoplasmic sperm injection (IVF/ICSI). Cochrane database SystRev [Internet]. 2018; 2:CD012693.
85. Alviggi C, Conforti A, Esteves SC, Andersen CY, Bosch E,  K, et al. Recombinant luteinizing hormone supplementation in assisted reproductive technology: a systematic review. Fertil Steril [Internet]. 2018; 109(4):644-64.
K, et al. Recombinant luteinizing hormone supplementation in assisted reproductive technology: a systematic review. Fertil Steril [Internet]. 2018; 109(4):644-64.
86. Engmann L, DiLuigi A, Schmidt D, Nulsen J, Maier D, Benadiva C. The use of gonadotropin-releasing hormone (GnRH) agonist to induce oocyte maturation after cotreatment with GnRH antagonist in high-risk patients undergoing in vitro fertilization prevents the risk of ovarian hyperstimulation syndrome: a prospective rando. Fertil Steril [Internet]. 2008; 89(1):84-91.
87. Melo M, Busso CE, Bellver J, Alama P, Garrido N, Meseguer M, et al. GnRH agonist versus recombinant HCG in an oocyte donation programme: a randomized, prospective, controlled, assessor-blind study. Reprod Biomed Online [Internet]. 2009; 19(4):486-92.
88. Wikland M, Blad S, Bungum L,  T,
T,  PO, Nilsson S. A randomized controlled study comparing pain experience between a newly designed needle with a thin tip and a standard needle for oocyte aspiration. Hum Reprod [Internet]. 2011; 26(6):1377-83.
PO, Nilsson S. A randomized controlled study comparing pain experience between a newly designed needle with a thin tip and a standard needle for oocyte aspiration. Hum Reprod [Internet]. 2011; 26(6):1377-83.
89. Weiss A, Neril R, Geslevich J, Lavee M, Beck-Fruchter R, Golan J, et al. Lag time from ovulation trigger to oocyte aspiration and oocyte maturity in assisted reproductive technology cycles: a retrospective study. Fertil Steril [Internet]. 2014; 102(2):419-23.
90. Nargund G, Reid F, Parsons J. Human chorionic gonadotropin-to-oocyte collection interval in a superovulation IVF program. A prospective study. J Assist Reprod Genet [Internet]. 2001; 18(2):87-90.
91. Bjercke S, Tanbo T, Dale PO, Abyholm T. Comparison between two hCG-to-oocyte aspiration intervals on the outcome of in vitro fertilization. J Assist Reprod Genet [Internet]. 2000; 17(6):319-22.
92. Wang W, Zhang X-H, Wang W-H, Liu Y-L, Zhao L-H, Xue S-L, et al. The time interval between hCG priming and oocyte retrieval in ART program: a meta-analysis. J Assist Reprod Genet [Internet]. 2011; 28(10):901-10.
93. Levy G, Hill MJ, Ramirez Cl, Correa L, Ryan ME, DeCherney AH, et al. The use of follicle flushing during oocyte retrieval in assisted reproductive technologies: a systematic review and meta-analysis. Hum Reprod [Internet]. 2012; 27(8):2373-9.
94. Moore DE, Soules MR, Klein NA, Fujimoto VY, Agnew KJ, Eschenbach DA. Bacteria in the transfer catheter tip influence the live-birth rate after in vitro fertilization. Fertil Steril [Internet]. 2000; 74(6):1118-24.
95. Glujovsky D, Farquhar C, Quinteiro Retamar AM, Alvarez Sedo CR, Blake D. Cleavage stage versus blastocyst stage embryo transfer in assisted reproductive technology. Cochrane database SystRev [Internet]. 2016; (6):CD002118.
96. Phillips SJ, Dean NL, Buckett WM, Tan SL. Consecutive transfer of day 3 embryos and of day 5-6 blastocysts increases overall pregnancy rates associated with blastocyst culture. J Assist Reprod Genet [Internet]. 2003; 20(11):461-4.
97. Eskandar MA, Abou-Setta AM, El-Amin M, Almushait MA, Sobande AA. Removal of cervical mucus prior to embryo transfer improves pregnancy rates in women undergoing assisted reproduction. Reprod Biomed Online [Internet]. 2007; 14(3):308-13.
98. Craciunas L, Tsampras N, Fitzgerald C. Cervical mucus removal before embryo transfer in women undergoing in vitro fertilization/intracytoplasmic sperm injection: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril [Internet]. 2014; 101(5):1302-7.
99. Practice Committee of the American Society for Reproductive Medicine. Electronic address: [email protected], Practice Committee of the American Society for Reproductive Medicine. Performing the embryo transfer: a guideline. Fertil Steril [Internet]. 2017; 107(4):882-96.
100. Brown J, Buckingham K, Buckett W, Abou-Setta AM. Ultrasound versus "clinical touch" for catheter guidance during embryo transfer in women. Cochrane database Syst Rev. 2016; 3:CD006107.
101. Sroga JM, Montville CP, Aubuchon M, Williams DB, Thomas MA. Effect of delayed versus immediate embryo transfer catheter removal on pregnancy outcomes during fresh cycles. Fertil Steril [Internet]. 2010; 93(6):2088-90.
102. Tiras B, Polat M, Korucuoglu U, Zeyneloglu HB, Yarali H. Impact of embryo replacement depth on in vitro fertilization and embryo transfer outcomes. Fertil Steril [Internet]. 2010; 94(4):1341-5.
103. Farquhar C, Rishworth JR, Brown J, Nelen WLDM, Marjoribanks J. Assisted reproductive technology: an overview of Cochrane Reviews. Cochrane database Syst Rev [Internet]. 2015; (7):CD010537.
104. Bontekoe S, Heineman MJ, Johnson N, Blake D. Adherence compounds in embryo transfer media for assisted reproductive technologies. Cochrane database Syst Rev [Internet], 2014; (2):CD007421.
105. Kroon B, Hart RJ, Wong BMS, Ford E, Yazdani A. Antibiotics prior to embryo transfer in ART. Cochrane database Syst Rev [Internet]. 2012; (3):CD008995.
106. van der Ven H, Diedrich K, Al-Hasani S, Pless V, Krebs D. The effect of general anaesthesia on the success of embryo transfer following human in-vitro fertilization. Hum Reprod [Internet]. 1988; 3 Suppl 2:81-3.
107. European IVF-monitoring Consortium (EIM), European Society of Human Reproduction and Embryology (ESHRE), Calhaz-Jorge C, De Geyter C, Kupka MS, de Mouzon J, et al. Assisted reproductive technology in Europe, 2013: results generated from European registers by ESHRE. Hum Reprod. 2017; 32(10):1957-73.
108. O'Flynn N. Assessment and treatment for people with fertility problems: NICE guideline. Br J Gen Pract [Internet]. 2014; 64(618):50-1.
109. Practice Committee of the American Society for Reproductive Medicine. Electronic address: [email protected], Practice Committee of the Society for Assisted Reproductive Technology. Guidance on the limits to the number of embryos to transfer: a committee opinion. Fertil Steril [Internet]. 2017; 107(4):901-3.
110. Mancuso AC, Boulet SL, Duran E, Munch E, Kissin DM, Van Voorhis BJ. Elective single embryo transfer in women less than age 38 years reduces multiple birth rates, but not live birth rates, in United States fertility clinics. Fertil Steril. 2016; 106(5):1107-14.
111. Kissin DM, Kulkarni AD, Mneimneh A, Warner L, Boulet SL, Crawford S, et al. Embryo transfer practices and multiple births resulting from assisted reproductive technology: an opportunity for prevention. Fertil Steril [Internet]. 2015; 103(4):954-61.
112. Soliman S, Daya S, Collins J, Hughes EG. The role of luteal phase support in infertility treatment: a meta-analysis of randomized trials. Fertil Steril [Internet]. 1994; 61(6):1068-76.
113. Connell MT, Szatkowski JM, Terry N, DeChemey AH, Propst AM, Hill MJ. Timing luteal support in assisted reproductive technology: a systematic review. Fertil Steril [Internet]. 2015; 103(4):939--946.e3.
114. van der Linden M, Buckingham K, Farquhar C, Kremer JAM, Metwally M. Luteal phase support for assisted reproduction cycles. Cochrane database Syst Rev. 2015; (7):CD009154.
115. Tovrnaye H, Sukhikh GT, Kahler E, Griesinger G. A Phase III randomized controlled trial comparing the efficacy, safety and tolerability of oral dydrogesterone versus micronized vaginal progesterone for luteal support in in vitro fertilization. Hum Reprod [Internet]. 2017; 32(10):2152.
116. Child T, Leonard SA, Evans JS, Lass A. Systematic review of the clinical efficacy of vaginal progesterone for luteal phase support in assisted reproductive technology cycles. Reprod Biomed Online [Internet]. 2018; 36(6):630-45.
117. Shapiro DB, Pappadakis JA, Ellsworth NM, Hait HI, Nagy ZP. Progesterone replacement with vaginal gel versus i.m. injection: cycle and pregnancy outcomes in IVF patients receiving vitrified blastocysts. Hum Reprod [Internet]. 2014; 29(8):1706-11.
118. Al-Ghamdi A, Coskun S, Al-Hassan S, Al-Rejjal R, Awartani K. The correlation between endometrial thickness and outcome of in vitro fertilization and embryo transfer (IVF-ET) outcome. Reprod Biol Endocrinol [Internet]. 2008; 6:37.
119. Применение эстрогенов в программах ВРТ. Научно-практические рекомендации. РАРЧ. 2015.
120. Kol S. Luteolysis induced by a gonadotropin-releasing hormone agonist is the key to prevention of ovarian hyperstimulation syndrome. Fertil Steril [Internet]. 2004; 81(1):1-5.
121. Humaidan P, Papanikolaou EG, Kyrou D, Alsbjerg B, Polyzos NP, Devroey P, et al. The luteal phase after GnRH-agonist triggering of ovulation: present and future perspectives. Reprod Biomed Online [Internet]. 2012; 24(2):134-41.
122. Xiao Z, Zhou X, Xu W, Yang J, Xie Q. Natural cycle is superior to hormone replacement therapy cycle for vitrificated-preserved frozen-thawed embryo transfer. Syst Biol Reprod Med [Internet]. 2012; 58(2):107-12.
123. Groenewoud ER, Macklon NS, Cohlen BJ, trial study group A. Cryo-thawed embryo transfer: natural versus artificial cycle. A non-inferiority trial. (ANTARCTICA trial). BMC Womens Health [Internet]. 2012; 12:27.
124. Liao X, Li Z, Dong X, Zhang H. Comparison between oral and vaginal estrogen usage in inadequate endometrial patients for frozen-thawed blastocysts transfer. Int J Clin Exp Pathol [Internet]. 2014; 7(10):6992-7.
125. Jung H, Roh HK. The effects of E2 supplementation from the early proliferative phase to the late secretory phase of the endometrium in hMG-stimulated IVF-ET. J Assist Reprod Genet [Internet]. 2000; 17(1):28-33.
126. Kastrop PM, Weima SM, Van Kooij RJ, Te Velde ER. Comparison between intracytoplasmic sperm injection and in-vitro fertilization (IVF) with high insemination concentration after total fertilization failure in a previous IVF attempt. Hum Reprod [Internet]. 1999; 14(1):65-9.
127. Verheyen G, Tournaye H, Staessen C, De Vos A, Vandervorst M, Van Steirteghem A. Controlled comparison of conventional in-vitro fertilization and intracytoplasmic sperm injection in patients with asthenozoospermia. Hum Reprod [Internet]. 1999; 14(9):2313-9.
128. Payne D, Flaherty SP, Jeffrey R, Wames GM, Matthews CD. Successful treatment of severe male factor infertility in 100 consecutive cycles using intracytoplasmic sperm injection. Hum Reprod [Internet]. 1994; 9(11):2051-7.
129. Plachot M, Belaisch-Allart J, Mayenga J-M, Chouraqui A, Tesquier L, Serkine AM. Outcome of conventional IVF and ICSI on sibling oocytes in mild male factor infertility. Hum Reprod [Internet]. 2002; 17(2):362-9.
130. Henkel RR, Schill W-B. Sperm preparation for ART. Reprod Biol Endocrinol [Internet]. 2003; 1:108.
131. ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos MJ, Apter S, Coticchio G, Debrock S, Lundin K, et al. Revised guidelines for good practice in IVF laboratories (2015). Hum Reprod. 2016; 31(4):685-6.
132. Assisted reproductive technology in Europe 2013: results generated from European registers by ESHRE., Calhaz-Jorge C, Christian De Geyter, M S Kupka et al. Revised guidelines for good practice in IVF laboratories (2015). Hum Reprod [Internet]. 2017; 32(10):1957-73.
133. Huang Z, Li J, Wang L, Yan J, Shi Y, Li S. Brief co-incubation of sperm and oocytes for in vitro fertilization techniques. Cochrane database Syst Rev [Internet]. 2013; (4):CD009391.
134. Kazem R, Thompson LA, Srikantharajah A, Laing MA, Hamilton MP, Templeton A. Cryopreservation of human oocytes and fertilization by two techniques: in-vitro fertilization and intracytoplasmic sperm injection. Hum Reprod [Internet]. 1995; 10(10):2650-4.
135. Gook DA, Edgar DH. Human oocyte cryopreservation. Hum Reprod Update [Internet]. 13(6):591-605.
136. Harton GL, Magli MC, Lundin K, Montag M, Lemmen J, Harper JC, et al. ESHRE PGD Consortium/Embryology Special Interest Group-best practice guidelines for polar body and embryo biopsy for preimplantation genetic diagnosis/screening (PGD/PGS). Hum Reprod [Internet]. 2011; 26(1):41-6.
137. Thornhill AR, DeDie-Smulders CE, Geraedts JP, Harper JC, Harton GL, Lavery SA, et al. ESHRE PGD Consortium "Best practice guidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS)". Hum Reprod [Internet]. 2005; 20(1):35-48.
138. ESHRE Capri Workshop Group. Intracytoplasmic sperm injection (ICSI) in 2006: evidence and evolution. Hum Reprod Update [Internet]. 13(6):515-26.
139. van der Westerlaken L, Helmerhorst F, Dieben S, Naaktgeboren N. Intracytoplasmic sperm injection as a treatment for unexplained total fertilization failure or low fertilization after conventional in vitro fertilization. Fertil Steril [Internet]. 2005; 83(3):612-7.
140. Practice Committees of the American Society for Reproductive Medicine and Society for Assisted Reproductive Technology. Intracytoplasmic sperm injection (ICSI) for non-male factor infertility: a committee opinion. Fertil Steril [Internet]. 2012; 98(6):1395-9.
141. Johnson LNC, Sasson IE, Sammel MD, Dokras A. Does intracytoplasmic sperm injection improve the fertilization rate and decrease the total fertilization failure rate in couples with well-defined unexplained infertility? A systematic review and meta-analysis. Fertil Steril [Internet]. 2013; 100(3):704-11.
142. Moreno C, Ruiz A,  C, Pellicer A,
C, Pellicer A,  J. Intracytoplasmic sperm injection as a routine indication in low responder patients. Hum Reprod [Internet]. 1998; 13(8):2126-9.
J. Intracytoplasmic sperm injection as a routine indication in low responder patients. Hum Reprod [Internet]. 1998; 13(8):2126-9.
143. Luna M, Bigelow C, Duke M, Ruman J, Sandler B, Grunfeld L, et al. Should ICSI be recommended routinely in patients with four or fewer oocytes retrieved? J Assist Reprod Genet [Internet]. 2011; 28(10):911-5.
144. Kim HH, Bundorf MK, Behr B, McCallum SW. Use and outcomes of intracytoplasmic sperm injection for non-male factor infertility. Fertil Steril [Internet]. 2007; 88(3):622-8.
145. Teixeira DM, Barbosa MAP, Ferriani RA, Navarro PA, Raine-Fenning N, Nastri CO, et al. Regular (ICSI) versus ultra-high magnification (IMSI) sperm selection for assisted reproduction. Cochrane database Syst Rev. 2013; (7):CD010167.
146. McDowell S, Kroon B, Ford E, Hook Y, Glujovsky D, Yazdani A. Advanced sperm selection techniques for assisted reproduction. Cochrane database Syst Rev. 2014; (10):CD010461.
147. Cohen J, Alikani M, Trowbridge J, Rosenwaks Z. Implantation enhancement by selective assisted hatching using zona drilling of human embryos with poor prognosis. Hum Reprod [Internet]. 1992; 7(5):685-91.
148. Zeng M, Su S, Li L. The effect of laser-assisted hatching on pregnancy outcomes of cryopreserved-thawed embryo transfer: a meta-analysis of randomized controlled trials. Lasers Med Sci [Internet]. 2018; 33(3):655-66.
149. Carney S-K, Das S, Blake D, Farquhar C, Seif MMW, Nelson L. Assisted hatching on assisted conception (in vitro fertilisation (IVF) and intracytoplasmic sperm injection (ICSI). Cochrane database SystRev. 2012; 12:CD001894.
150. Capalbo A, Romanelli V, Cimadomo D, Girardi L, Stoppa M, Dovere L, et al. Implementing PGD/PGD-A in IVF clinics: considerations for the best laboratory approach and management. J Assist Reprod Genet [Internet]. 2016; 33(10):1279-86.
151. Martins WP, Rocha IA, Ferriani RA, Nastri CO. Assisted hatching of human embryos: a systematic review and meta-analysis of randomized controlled trials. Hum Reprod Update [Internet]. 17(4):438-53.
152. Li D, Yang D-L, An J, Jiao J, Zhou Y-M, Wu Q-J, et al. Effect of assisted hatching on pregnancy outcomes: a systematic review and meta-analysis of randomized controlled trials. Sci Rep [Internet]. 2016; 6:31228.
153. Goossens V, De Rycke M, De Vos A, Staessen C, Michiels A, Verpoest W, et al. Diagnostic efficiency, embryonic development and clinical outcome after the biopsy of one or two blastomeres for preimplantation genetic diagnosis. Hum Reprod [Internet]. 2008; 23(3):481-92.
154. De Vos A, Staessen C, De Rycke M, Verpoest W, Haentjens P, Devroey P, et al. Impact of cleavage-stage embryo biopsy in view of PGD on human blastocyst implantation: a prospective cohort of single embryo transfers. Hum Reprod [Internet]. 2009; 24(12):2988-96.
155.  S, Cohen J. Unsuitability of multinucleated human blastomeres for preimplantation genetic diagnosis. Hum Reprod [Internet] 1993; 8(7):1120-5.
S, Cohen J. Unsuitability of multinucleated human blastomeres for preimplantation genetic diagnosis. Hum Reprod [Internet] 1993; 8(7):1120-5.
156. Gardner DK, Weissman A, Howies CM, Shoham Z, editors. Textbook of Assisted Reproductive Technologies. III. London: Informa healthcare; 2009. 912 p.
157. PGDIS Newsletter, July 19, 2016: PGDIS POSITION STATEMENT ON CHROMOSOME MOSAICISM AND PREIMPLANTATION ANEUPLOIDY TESTING AT THE BLASTOCYST STAGE.
158. Cobo A, Meseguer M,  J, Pellicer A. Use of cryo-banked oocytes in an ovum donation programme: a prospective, randomized, controlled, clinical trial. Hum Reprod. 2010; 25(9):2239-46.
J, Pellicer A. Use of cryo-banked oocytes in an ovum donation programme: a prospective, randomized, controlled, clinical trial. Hum Reprod. 2010; 25(9):2239-46.
159. Cobo A, Garrido N, Pellicer A,  J. Six years' experience in ovum donation using vitrified oocytes: report of cumulative outcomes, impact of storage time, and development of a predictive model for oocyte survival rate. Fertil Steril [Internet]. 2015; 104(6):1426-8.
J. Six years' experience in ovum donation using vitrified oocytes: report of cumulative outcomes, impact of storage time, and development of a predictive model for oocyte survival rate. Fertil Steril [Internet]. 2015; 104(6):1426-8.
160. Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The Istanbul consensus workshop on embryo assessment: proceedings of an expert meeting. Hum Reprod [Internet]. 2011; 26(6):1270-83.
161. Maheshwari A, Pandey S, Amalraj Raja E, Shetty A, Hamilton M, Bhattacharya S. Is frozen embryo transfer better for mothers and babies? Can cumulative meta-analysis provide a definitive answer? Hum Reprod Update. 2018; 24(1):35-58.
162. Rienzi L, Gracia C, Maggiulli R, LaBarbera AR, Kaser DJ, Ubaldi FM, et al. Oocyte, embryo and blastocyst cryopreservation in ART: systematic review and meta-analysis comparing slow-freezing versus vitrification to produce evidence for the development of global guidance. Hum Reprod Update. 2017; 23(2):139-55.
163. Shi Q, Xie Y, Wang Y, Li S. Vitrification versus slow freezing for human ovarian tissue cryopreservation: a systematic review and meta-anlaysis. Sci Rep [Internet]. 2017; 7(1):8538.
164. Zhou X-H, Zhang D, Shi J, Wu Y-J. Comparison of vitrification and conventional slow freezing for cryopreservation of ovarian tissue with respect to the number of intact primordial follicles: A meta-analysis. Medicine (Baltimore) [Internet]. 2016; 95(39):e4095.
165. Justice T, Christensen G. Sperm cryopreservation methods. Methods Mol Biol [Internet]. 2013; 927:209-15.
166. Levron J, Madgar I, Shefi S, Meirow D, Wiser A, Bider D, et al. IVF outcome with cryopreserved testicular sperm. Andrologia [Internet]. 2011; 43(1):48-51.
167. Hovatta O, Foudila T, Siegberg R, Johansson K, von Smitten K, Reima I. Pregnancy resulting from intracytoplasmic injection of spermatozoa from a frozen-thawed testicular biopsy specimen. Hum Reprod [Internet]. 1996; 11(11):2472-3.
168. Zegers-Hochschild F, Adamson GD, Dyer S, Racowsky C, de Mouzon J, Sokol R, et al. The International Glossary on Infertility and Fertility Care, 2017. Fertil Steril. 2017; 108(3):393-406.
169. Liss J, Chromik I,  J,
J,  M,
M,  A,
A,  K. Current methods for preimplantation genetic diagnosis. Ginekol Pol [Internet]. 2016; 87(7):522-6.
K. Current methods for preimplantation genetic diagnosis. Ginekol Pol [Internet]. 2016; 87(7):522-6.
170. Kane SC, Willats E, Bezerra Maia E Holanda Moura S, Hyett J, da Silva Costa F. Pre-Implantation Genetic Screening Techniques: Implications for Clinical Prenatal Diagnosis. Fetal Diagn Ther [Internet]. 2016; 40(4):241-54.
171. Brezina PR, Anchan R, Kearns WG. Preimplantation genetic testing for aneuploidy: what technology should you use and what are the differences? J Assist Reprod Genet. 2016; 33(7):823-32.
172. Prevention of twin pregnancies after IVF/ICSI by single embryo transfer. ESHRE Campus Course Report. Hum Reprod [Internet]. 2001; 16(4):790-800.
173. Корнеева Е.И. Федеральные клинические рекомендации. Диагностика и лечение синдрома гиперстимуляции яичников. Москва; 2013.
174. Корсак В.С., Смирнова А.А., Шурыгина О.В. Регистр центров ВРТ в России. Отчет за 2015 г. Проблемы репродукции. 2017; 23(5):8-22.
175. Lensen SF, Wilkinson J, Leijdekkers JA, La Marca A, Mol BWJ, Marjoribanks J, et al. Individualised gonadotropin dose selection using markers of ovarian reserve for women undergoing in vitro fertilisation plus intracytoplasmic sperm injection (IVF/ICSI). Cochrane database Syst Rev. 2018; 2:CD012693.
176. Casper RF. Reducing the Risk of OHSS by GnRH Agonist Triggering. J Clin Endocrinol Metab [Internet]. 2015; 100(12):4396-8.
177. Tang H, Mourad S, Zhai S-D, Hart RJ. Dopamine agonists for preventing ovarian hyperstimulation syndrome. Cochrane database Syst Rev [Internet]. 2016; 11:CD008605.
178. Leitao VMS, Moroni RM, Seko LMD, Nastri CO, Martins WP. Cabergoline for the prevention of ovarian hyperstimulation syndrome: systematic review and meta-analysis of randomized controlled trials. Fertil Steril [Internet]. 2014; 101(3):664-75.
179. Das M, Son W-Y, Buckett W, Tulandi T, Holzer H. In-vitro maturation versus IVF with GnRH antagonist for women with polycystic ovary syndrome: treatment outcome and rates of ovarian hyperstimulation syndrome. Reprod Biomed Online [Internet]. 2014; 29(5):545-51.
180. Refaat B, Dalton E, Ledger WL. Ectopic pregnancy secondary to in vitro fertilisation-embryo transfer: pathogenic mechanisms and management strategies. Reprod Biol Endocrinol [Internet], 2015; 13:30.
181. Shaw JL V, Dey SK, Critchley HOD, Horne AW. Current knowledge of the aetiology of human tubal ectopic pregnancy. Hum Reprod Update [Internet]. 16(4):432-44.
182. Ankum WM, Mol BW, Van der Veen F, Bossuyt PM. Risk factors for ectopic pregnancy: a meta-analysis. Fertil Steril [Internet]. 1996; 65(6): 1093-9.
183. Audebert A, Pouly JL, Bonifacie B, Yazbeck C. Laparoscopic surgery for distal tubal occlusions: lessons learned from a historical series of 434 cases. Fertil Steril [Internet]. 2014; 102(4):1203-8.
184. Hjordt Hansen M V, Dalsgaard T, Hartwell D, Skovlund CW, Lidegaard O. Reproductive prognosis in endometriosis. A national cohort study. Acta Obstet Gynecol Scand [Internet]. 2014; 93(5):483-9.
185. Egbase PE, Al-Sharhan M, Grudzinskas JG. Influence of position and length of uterus on implantation and clinical pregnancy rates in IVF and embryo transfer treatment cycles. Hum Reprod [Internet]. 2000; 15(9):1943-6.
186. Nazari A, Askari HA, Check JH, O'Shaughnessy A. Embryo transfer technique as a cause of ectopic pregnancy in in vitro fertilization. Fertil Steril [Internet]. 1993; 60(5):919-21.
187. Pandian Z, Marjoribanks J, Ozturk O, Serour G, Bhattacharya S. Number of embryos for transfer following in vitro fertilisation or intra-cytoplasmic sperm injection. Cochrane database SystRev. 2013; (7):CD003416.
188. Vloeberghs V, Peeraer K, Pexsters A, D'Hooghe T. Ovarian hyperstimulation syndrome and complications of ART. Best Pract Res Clin Obstet Gynaecol [Internet]. 2009; 23(5):691-709.
189.  S, Kumbasar S, Savan K. Evaluation of complications developing during and after transvaginal ultrasound - guided oocyte retrieval. Ginekol Pol [Internet]. 2018; 89(1):1-6.
S, Kumbasar S, Savan K. Evaluation of complications developing during and after transvaginal ultrasound - guided oocyte retrieval. Ginekol Pol [Internet]. 2018; 89(1):1-6.
190. Bodri D,  JJ, Polo A, Trullenque M, Esteve C, Coll O. Complications related to ovarian stimulation and oocyte retrieval in 4052 oocyte donor cycles. Reprod Biomed Online [Internet]. 2008; 17(2):237-43.
JJ, Polo A, Trullenque M, Esteve C, Coll O. Complications related to ovarian stimulation and oocyte retrieval in 4052 oocyte donor cycles. Reprod Biomed Online [Internet]. 2008; 17(2):237-43.
191. Sarhan A, Muasher SJ. Surgical complications of in vitro fertilization. Review. Middle East Fert Soc J. 2007; 12(1):N1.
192. Serour GI, Aboulghar M, Mansour R, Sattar MA, Amin Y, Aboulghar H. Complications of medically assisted conception in 3,500 cycles. Fertil Steril [Internet]. 1998; 70(4):638-42.
193. Roest J, Mous H V, Zeilmaker GH, Verhoeff A. The incidence of major clinical complications in a Dutch transport IVF programme. Hum Reprod Update [Internet]. 2(4):345-53.
194. Govaerts I, Devreker F, Delbaere A, Revelard P, Englert Y. Short-term medical complications of 1500 oocyte retrievals for in vitro fertilization and embryo transfer. Eur J Obstet Gynecol Reprod Biol [Internet]. 1998; 77(2):239-43.
195. Кулаков В.И., Леонов Б.В. Экстракорпоральное оплодотворение и его новые направления в лечении женского и мужского бесплодия (теоретические и практические подходы): Руководство для врачей. МИА. Москва; 2004. 782 p.
196. Mashiach S, Bider D, Moran O, Goldenberg M, Ben-Rafael Z. Adnexal torsion of hyperstimulated ovaries in pregnancies after gonadotropin therapy. Fertil Steril [Internet]. 1990; 53(1):76-80.
197. Romanski PA, Melamed A, Elias KM, Stanic AK, Anchan RM. Association between peak estradiol levels and ovarian torsion among symptomatic patients receiving gonadotropin treatment. J Assist Reprod Genet [Internet], 2017; 34(5):627-31.
198. Kemmann E, Ghazi DM, Corsan GH. Adnexal torsion in menotropin-induced pregnancies. Obstet Gynecol [Internet]. 1990; 76(3 Pt 1):403-6.
199. Chang HC, Bhatt S, Dogra VS. Pearls and pitfalls in diagnosis of ovarian torsion. Radiographics [Internet]. 28(5): 1355-68.
200. Huchon C, Fauconnier A. Adnexal torsion: a literature review. Eur J Obstet Gynecol Reprod Biol [Internet]. 2010; 150(1):8-12.
201. Mashiach R, Melamed N, Gilad N, Ben-Shitrit G, Meizner I. Sonographic diagnosis of ovarian torsion: accuracy and predictive factors. J Ultrasound Med [Internet]. 2011; 30(9):1205-10.
202. Steyaert SR, Leroux-Roels GG, Dhont M. Infections in IVF: review and guidelines. Hum Reprod Update [Internet]. 6(5):432-41.
203. Pereira N, Hutchinson AP, Lekovich JP, Hobeika E, Elias RT. Antibiotic Prophylaxis for Gynecologic Procedures prior to and during the Utilization of Assisted Reproductive Technologies: A Systematic Review. J Pathog [Internet]. 2016; 2016:4698314.
204. Practice Committee of American Society for Reproductive Medicine, Practice Committee of Society for Assisted Reproductive Technology. Recommendations for gamete and embryo donation: a committee opinion. Fertil Steril [Internet]. 2013; 99(1):47-62.
205. Cakmak H, Rosen MP. Ovarian stimulation in cancer patients. Fertil Steril. 2013; 99(6): 1476-84.
206. Coyne K, Purdy M,  Leary K, Yaklic JL, Lindheim SR, Appiah LA. Challenges and Considerations in Optimizing Ovarian Stimulation Protocols in Oncofertility Patients. Front Public Heal [Internet]. 2014; 2.
Leary K, Yaklic JL, Lindheim SR, Appiah LA. Challenges and Considerations in Optimizing Ovarian Stimulation Protocols in Oncofertility Patients. Front Public Heal [Internet]. 2014; 2.
207. Practice Committees of the American Society for Reproductive Medicine and the Society for Assisted Reproductive Technology. In vitro maturation: a committee opinion. Fertil Steril [Internet]. 2013; 99(3):663-6.
208. Shalom-Paz E, Almog B, Shehata F, Huang J, Holzer H, Chian R-C, et al. Fertility preservation for breast-cancer patients using IVM followed by oocyte or embryo vitrification. Reprod Biomed Online [Internet]. 2010; 21(4):566-71.
209. Reddy J, Turan V, Bedoschi G, Moy F, Oktay K. Triggering final oocyte maturation with gonadotropin-releasing hormone agonist (GnRHa) versus human chorionic gonadotropin (hCG) in breast cancer patients undergoing fertility preservation: an extended experience. J Assist Reprod Genet [Internet]. 2014; 31(7):927-32.
210. Semprini AE, Macaluso M, Hollander L, Vucetich A, Duerr A, Mor G, et al. Safe conception for HIV-discordant couples: insemination with processed semen from the HIV-infected partner. Am J Obstet Gynecol [Internet]. 2013; 208(5):402.e1--9.
211. Marques C, Guerreiro C, Soares SR. Lights and Shadows about the Effectiveness of IVF in HIV Infected Women: A Systematic Review. Infect Dis Obstet Gynecol [Internet]. 2015; 2015:517208.
Приложение А1
СОСТАВ РАБОЧЕЙ ГРУППЫ
|
N
|
ФИО
|
Уч. степень, звание
|
Должность
|
Место работы
|
|
1.
|
Абубакиров Айдар Назимович
|
Кандидат медицинских наук
|
Руководитель 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
2.
|
Адамян Лейла Владимировна
|
Академик РАН, доктор медицинских наук, профессор, главный внештатный акушер-гинеколог Минздрава России
|
Заместитель директора по научной работе
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
3.
|
Андреева Елена Николаевна
|
Доктор медицинских наук
|
Директор института репродуктивной медицины
|
ФГБУ "НМИЦ эндокринологии" Минздрава России
|
|
4.
|
Аншина Маргарита Бениаминовна
|
Кандидат медицинских наук
|
Г енеральный директор
|
ООО Центр репродукции и генетики "ФертиМед"
|
|
5.
|
Веюкова Мария Александровна
|
Кандидат биологических наук
|
Эмбриолог 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
6.
|
Воронин Евгений Евгеньевич
|
Доктор медицинских наук, профессор
|
Главный врач, руководитель научно-практического центра по профилактике и лечению ВИЧ-инфекции у беременных женщин и детей
|
ФКУ "Республиканская клиническая инфекционная больница" Минздрава России
|
|
7.
|
Гависова Алла Анатольевна
|
Кандидат медицинских наук
|
Старший научный сотрудник 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
8.
|
Гзгзян Александр Мкртичевич
|
Доктор медицинских наук
|
Руководитель отделения ВРТ
|
ФГБНУ "НИИ АГиР имени Д.О. Отта"
|
|
9.
|
Гусев Дмитрий Вадимович
|
Научный сотрудник отделения гинекологической эндокринологии
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
|
10.
|
Долгушина Наталия Витальевна
|
Доктор медицинских наук, профессор
|
Заместитель директора - руководитель департамента организации научной деятельности
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
11.
|
Исакова Эльвира Валентиновна
|
Кандидат медицинских наук
|
Заведующий отделением ВРТ
|
АО "Международный центр репродуктивной медицины"
|
|
12.
|
Калинина Елена Андреевна
|
Доктор медицинских наук
|
Директор
|
Клиника репродуктивного здоровья "АРТ-ЭКО"
|
|
13.
|
Калинина Елена Анатольевна
|
Доктор медицинских наук, профессор
|
Заведующий отделением вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
14.
|
Калугина Алла Станиславовна
|
Доктор медицинских наук, профессор
|
Зам. главного врача по гинекологии и репродуктивной медицине
|
Клиника "АВА-Петер"
|
|
15.
|
Коган Игорь Юрьевич
|
Член-корр. РАН, доктор медицинских наук, профессор
|
ВРИО Директора
|
ФГБНУ "НИИ АГиР имени Д.О. Отта"
|
|
16.
|
Кодылева Татьяна Александровна
|
Эмбриолог 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
|
17.
|
Козаченко Ирена Феликсовна
|
Кандидат медицинских наук
|
Старший научный сотрудник гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
18.
|
Колода Юлия Алексеевна
|
Кандидат медицинских наук
|
Доцент
|
Кафедра акушерства и гинекологии РМАНПО
|
|
19.
|
Корнеев Игорь Алексеевич
|
Доктор медицинских наук, профессор
|
Профессор
|
Кафедра урологии ФГБОУ ВО "ПСПбГМУ им. акад. И.П. Павлова" Минздрава России
|
|
20.
|
Корнеева Ирина Евгеньевна
|
Доктор медицинских наук
|
Руководитель НОЦ ВРТ им. Паулсена
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
21.
|
Корсак Владислав Станиславович
|
Доктор медицинских наук, профессор, президент РАРЧ
|
Г енеральный директор
|
АО "Международный центр репродуктивной медицины"
|
|
22.
|
Краснопольская Ксения Владиславовна
|
Доктор медицинских наук, профессор, член-корр. РАН
|
Руководитель отделения репродуктологии
|
ГБУЗ "МОНИИАГ"
|
|
23.
|
Латышева Инга Борисовна
|
Кандидат медицинских наук
|
Заместитель главного врача по организационно-методической работе
|
ФКУ "Республиканская клиническая инфекционная больница" Минздрава России
|
|
24.
|
Мишиева Нона Годовна
|
Доктор медицинских наук
|
Ведущий научный сотрудник 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
25.
|
Митюрина Елена Викторовна
|
Кандидат медицинских наук
|
Врач 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
26.
|
Назаренко Татьяна Алексеевна
|
Доктор медицинских наук, профессор
|
Директор института репродуктивной медицины
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
27.
|
Никитин Анатолий Илларионович
|
Доктор медицинских наук, профессор
|
Генеральный директор
|
Балтийский институт репродуктологии человека
|
|
28.
|
Овчинников Руслан Игоревич
|
Кандидат медицинских наук
|
Зав. по клинической работе отделения андрологии и урологии
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
29.
|
Перминова Светлана Григорьевна
|
Доктор медицинских наук
|
Ведущий научный сотрудник 1-го гинекологического отделения
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
30.
|
Померанцева Екатерина Алексеевна
|
Кандидат биологических наук
|
Руководитель лаборатории
|
Центр Генетики и Репродуктивной Медицины "ГЕНЕТИКО"
|
|
31.
|
Попов Александр Анатольевич
|
Доктор медицинских наук, профессор, вице-президент РАРЧ
|
Руководитель отдела - руководитель отдела эндоскопической хирургии
|
ГБУЗ "МОНИИАГ"
|
|
32.
|
Решетников Игорь Владимирович
|
Кандидат биологических наук
|
Эмбриолог
|
АО "Международный центр репродуктивной медицины"
|
|
33.
|
Рудакова Елена Борисовна
|
Доктор медицинских наук, профессор
|
Зав. отделением ВРТ
|
ГБУЗ МО "Московский областной перинатальный центр"
|
|
34.
|
Савина Валентина Андреевна
|
Кандидат медицинских наук
|
Врач акушер- гинеколог
|
АО "Международный центр репродуктивной медицины"
|
|
35.
|
Сагамонова Карина Юрьевна
|
Доктор медицинских наук, профессор
|
Директор
|
ООО "Центр репродукции человека и ЭКО"
|
|
36.
|
Серебренникова Клара Георгиевна
|
Доктор медицинских наук, профессор
|
Научный руководитель по акушерству и гинекологии
|
ФГБУ ЦКБ РАН
|
|
37.
|
Смирнова Анна Анатольевна
|
Кандидат медицинских наук
|
Доцент кафедры
|
Кафедра женских болезней и репродуктивного здоровья Института усовершенствования врачей НМХЦ им. Н.И. Пирогова, Москва
|
|
38.
|
Смольникова Вероника Юрьевна
|
Доктор медицинских наук
|
Ведущий научный сотрудник отделения вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
39.
|
Сыркашева Анастасия Григорьевна
|
Кандидат медицинских наук
|
Старший научный сотрудник отделения вспомогательных технологий в лечении бесплодия им. проф. Б.В. Леонова
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
40.
|
Тиселько Анна Викторовна
|
Кандидат медицинских наук
|
Старший научный сотрудник отделения гинекологической эндокринологии
|
ФГБНУ "НИИ АГиР имени Д.О. Отта"
|
|
41.
|
Филиппов Олег Семенович
|
Доктор медицинских наук, профессор
|
Заместитель директора Департамента медицинской помощи детям и службы родовспоможения
|
Минздрав РФ
|
|
42.
|
Чернуха Галина Евгеньевна
|
Доктор медицинских наук, профессор
|
Заведующий отделением гинекологической эндокринологии
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
43.
|
Шамугия Нато Ливтеровна
|
Кандидат медицинских наук, доцент
|
Главный врач
|
ООО Центр репродукции и генетики "ФертиМед"
|
|
44.
|
Шахова Марина Александровна
|
Доктор медицинских наук
|
Начальник отдела контроля качества в ВРТ
|
ФГБУ "НМИЦ АГП им. В.И. Кулакова" Минздрава России
|
|
45.
|
Шереметьева Екатерина Викторовна
|
Кандидат медицинских наук
|
Врач консультативно диагностического отделения
|
ФГБУ "НМИЦ эндокринологии" Минздрава России
|
|
37.
|
Ярмолинская Мария Игоревна
|
Доктор медицинских наук, профессор РАН
|
Руководитель отдела эндокринологии репродукции
|
ФГБНУ "НИИ АГиР имени Д.О. Отта"
|
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория данных клинических рекомендаций - врачи акушеры-гинекологи; студенты, ординаторы, аспиранты; преподаватели, научные сотрудники.
В данных клинических рекомендациях все сведения ранжированы по уровню убедительности рекомендаций и достоверности доказательств в зависимости от количества и качества исследований по данной проблеме.
Уровни достоверности доказательств
для диагностических вмешательств
|
УДД
|
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
|
|
1
|
Систематические обзоры исследований с контролем референсным методом
|
|
2
|
Отдельные исследования с контролем референсным методом
|
|
3
|
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
|
|
4
|
Несравнительные исследования, описание клинического случая
|
|
5
|
Имеется лишь обоснование механизма действия или мнение экспертов
|
Уровни убедительности рекомендаций
для диагностических вмешательств
|
УУР
|
Расшифровка
|
|
A
|
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качеств, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Низкая (слабая) рекомендация - отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Возможные комбинации УДД и УУР
для диагностических вмешательств
|
УДД
|
Критерии определения УУР
|
Итоговый УУР
|
|
1 = Наиболее достоверные доказательства: систематические обзоры исследований с контролем референсным методом
|
Одновременное выполнение двух условий:
1. Все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам являются согласованными <*>
|
A
|
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
C
|
|
|
2 = Отдельные исследования с контролем референсным методом
|
Одновременное выполнение двух условий:
1. Все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам являются согласованными <*>
|
A
|
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
C
|
|
|
3 = Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
C
|
|
|
4 = Несравнительные исследования, описание клинического случая
|
C
|
|
|
5 = Наименее достоверные доказательства: имеется лишь обоснование механизма действия или мнение экспертов
|
C
|
|
--------------------------------
<*> Если оценивается одно КИ, то данное условие не учитывается.
Уровни достоверности доказательств для лечебных
и профилактических вмешательств
|
УДД
|
Иерархия дизайнов клинических исследований по убыванию уровня достоверности доказательств от 1 до 5
|
|
1
|
Систематический обзор РКИ с применением мета-анализа
|
|
2
|
Отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением мета-анализа
|
|
3
|
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования
|
|
4
|
Несравнительные исследования, описание клинического случая или серии случаев, исследования "случай-контроль"
|
|
5
|
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
|
Уровни убедительности рекомендаций для лечебных
и профилактических вмешательств
|
УУР
|
Расшифровка
|
|
A
|
Однозначная (сильная) рекомендация (все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
|
|
B
|
Неоднозначная (условная) рекомендация (не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
|
|
C
|
Низкая (слабая) рекомендация - отсутствие доказательств надлежащего качества (все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
|
Возможные комбинации УДД и УУР для лечебных
и профилактических вмешательств
|
УДД
|
Критерии определения УУР
|
Итоговый УУР
|
|
1 = Наиболее достоверные доказательства: систематические обзоры РКИ с применением метаанализа
|
Одновременное выполнение двух условий:
1. Все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам являются согласованными <*>
|
A
|
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными
|
C
|
|
|
2 = отдельные РКИ и систематические обзоры исследований любого дизайна (помимо РКИ) с применением метаанализа
|
Одновременное выполнение двух условий:
1. Все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам являются согласованными <*>
|
A
|
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
C
|
|
|
3 = Нерандомизированные сравнительные исследования в т.ч. когортные исследования
|
Одновременное выполнение двух условий:
1. Все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам являются согласованными <*>
|
A
|
|
Выполнение хотя бы одного из условий:
1. Не все исследования имеют высокое или удовлетворительное методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
B
|
|
|
Выполнение хотя бы одного из условий:
1. Все исследования имеют низкое методологическое качество;
2. Выводы исследований по интересующим исходам не являются согласованными <*>
|
C
|
|
|
4 = Несравнительные исследования, описание клинического случая или серии случаев
|
C
|
|
|
5 = Наименее достоверные доказательства: имеется лишь обоснование механизма действия (доклинические исследования) или мнение экспертов
|
C
|
|
--------------------------------
<*> Если оценивается одно КИ, то данное условие не учитывается.
Порядок обновления клинических рекомендаций - пересмотр 1 раз в 3 года
Приложение А3
СВЯЗАННЫЕ ДОКУМЕНТЫ
Данные клинические рекомендации разработаны с учетом следующих нормативно-правовых документов:
a. Порядок использования вспомогательных репродуктивных технологий, противопоказаниях и ограничениях к их применению (приказ Министерства здравоохранения Российской Федерации от 30 августа 2012 г. N 107н).
b. Порядок оказания медицинской помощи по профилю "акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)" (приказ Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. N 572н).
c. Приказ Минздрава России от 10 мая 2017 г. N 203н "Об утверждении критериев оценки качества медицинской помощи".
d. Санитарно-эпидемиологические правила "Профилактика ВИЧ-инфекции" (постановление Главного государственного врача РФ от 11 января 2011 г. N 1 (ред. от 21.07.2016 г.).
e. Федеральный закон от 21.11.2011 N 323-ФЗ (ред. от 21.07.2014) "Об основах охраны здоровья граждан в Российской Федерации".
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА (БЛОК-СХЕМЫ)
Бесплодный брак
(N97.0, N97.1, N97.2, N97.3, N97.4, N97.8, N97.9, N46)

Женское бесплодие, связанное с отсутствием овуляции N97.0
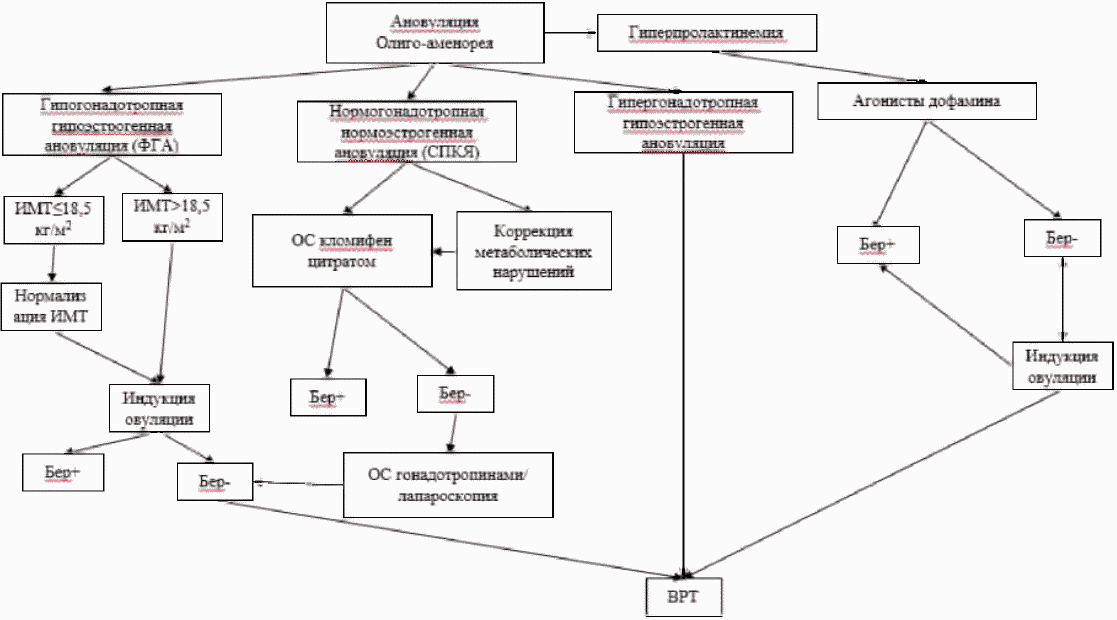
Женское бесплодие маточного происхождения N97.2

Женское бесплодие трубного происхождения N97.1

Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТОВ
Вероятность зачатия самая высокая в первые месяцы незащищеннго полового акта и постепенно снижается. Примерно у 80% супружеских пар беременность наступает в течение первых 6 месяцев.
Время зачатия увеличивается с возрастом. Способность к зачатию у женщин значительно снижается после 35 лет. У мужчины параметры спермы также снижаются после 35 лет, но способность к оплодотворению яйцеклетки может не изменяться до 50 лет.
Вероятность зачатия возрастает с частотой полового акта каждые 2 дня. У мужчин с нормальным качеством спермы, ее концентрация и подвижность остаются нормальными даже при ежедневной эякуляции.
Вероятный интервал зачатия определяют, как 6-дневный интервал, заканчивающийся в день овуляции. Но, наиболее оптимальное время для зачатия, это последние 2 - 3 дня перед овуляцией, определяемой по мочевому тесту. Определение оптимального интервала зачатия наиболее актуально у супружеских пар с редкими половыми актами.
Использование вагинальных смазок на водной и силиконовой основе, а также оливковое масло, могут ухудшать выживаемость сперматозоидов и снижать вероятность зачатия.
Нет никаких доказательств, что положение тела во время полового акта и после него может влиять на вероятность зачатия.
Здоровый образ жизни, правильное питание, нормальный вес могут увеличить вероятность зачатия у женщин с овуляторной дисфункцией. Время зачатия увеличивается в 2 раза при ожирении.
Женщина, планирующая беременность, должна до зачатия и до 12 недель беременности принимать фолиевую кислоту в дозе 400 мкг/сут для снижения риска аномалий нервной трубки у плода.
Потребление алкоголя в количестве 10 - 20 г этанола в день и кофеина (более 5 чашек в день) может отрицательно влиять на возможность наступления беременности. Возможно, курение ускоряет возрастное снижение запаса фолликулов в яичниках. У курящих женщин менопауза наступает на 1 - 4 года раньше, чем у некурящих.
Во время беременности потребление кофеина более 200 - 300 мг (2 - 3 чашки) увеличивает риск самопроизвольных выкидышей, но не влияет на риск врожденных аномалий плода.
Посещение сауны не снижает шансы на зачатие у женщины и безопасно при неосложненной беременности. У мужчин образ жизни целесообразно направить на уменьшение тепловых воздействий на яички.
Мужчина или женщина, планирующие беременность и имеющие хронические вирусные инфекции, такие как гепатит B, гепатит C или ВИЧ, должны быть направлены в специализированные центры, имеющие соответствующий опыт и возможности для обеспечения адекватного наблюдения с оценкой всех рисков в отношении рождения здорового потомства.
Для женщин моложе 35 лет консультации акушера-гинеколога для обследования и лечения следует начинать после 12 месяцев безуспешных попыток естественного зачатия. Для женщин старше 35 лет - через 6 месяцев.
Для обследования в связи с отсутствием беременности супружеской паре необходимо обратиться к акушеру-гинекологу и урологу для первичной консультации.
Обследвание супружеской пары начинают одновременно: женщина - у гинеколога, мужчина - у андролога. Обследование проводят в поликлинике.
Обследование для выявления причины бесплодия у женщины:
- беседа с врачом для оценки жалоб и данных о характере менструаций, ранее пересенных заболеваниях, предшествующем лечении;
- исследование на наличие инфекций;
- оценка овуляции (по данным мочевого теста на овуляцию и уровню прогестерона в крови, определяемому за 6 - 7 дней до предполагаемой менструации);
- оценка проходимости маточных труб по данным рентгенологического исследования (гистеросальпингографии);
- оценка матки и ее придатков по данным ультразвукового обследования (определяют размеры матки, яичников, количество фолликулол в в яичниках).
Если у женщины регулярный менструальный цикл и подтверждена овуляция - нет необходимости определять весь спектр гормонов в крови, так как их показатели не имеют клинического значения в данном случае.
Исключением является антимюллеров гормон (АМГ). По уровню этого гормона врач оценивает запас фолликулов в яичниках. Это важно для определения дальнейшего лечения.
Обследование мужчины начинают с анализа спермы. Это самый важный показатель. Дальнейший перечень обследования определяет андролог.
Обследование занимает 1 - 2 месяца. По результатам обследования врач назначает лечение. В 10 - 15% случаев у супружеской пары не удается установить причину бесплодия. У таких пар самым эффективным методом лечения явлется программа ЭКО.
В настоящее время ЭКО - самый эффективный метод достижения беременности не только у супружеских пар с неустановленной причиной бесплодия, но и при всех остальных причинах отсутствия беременности как у женщин, так и у мужчин.
Программа ЭКО включает:
- стимуляцию ячников, для того чтобы вызвать рост не одного, а нескольких фолликулов и получить несколько яйцеклеток для оплодотворения;
- пункцию фолликулов и забор яйцеклеток,
- оплодотворение яйцеклеток спермой;
- культивирование эмбрионов;
- перенос эмбрионов в полость матки.
Результат программы ЭКО оценивают через 14 дней по мочевому тесту на беременность или по уровню ХГЧ в крови.
Ожидаемая частота наступления беременности у женщин до 35 лет составляет около 30%. После 35 лет этот показатель снижается в 2 раза, а после 40 лет достигает минимальных значений. С возрастом организм женщины стареет, и, хотя запас фолликулов в яичниках еще есть, начинают созревать яйцеклетки, неспособные дать нормальный генетический потенциал эмбриону. При переносе таких эмбрионов в полость матки беременность не наступает или прерывается на раннем сроке.
Преимплантационное генетическое тестирование эмбрионов в программе ЭКО помогает решить эту проблему и перенести в полость матки генетически здоровый эмбрион, значительно повышая шансы не только наступления беременности, но и ее вынашивания. Сегодня такая возможность имеется во всех клиниках, проводящих программы ВРТ.
Необходимость подговки к программе ЭКО и перечень лечебных мероприятий определяет врач по результатам амбулаторного обследования.
Женщинам с ожирением (ИМТ >= 30 кг/м2) рекомендовано снижение веса и коррекция метаболических нарушений. Нормальный вес - залог большего успеха программ ВРТ.
При выявлении патологии в полости матки (полипы, подслизистые миомы, синехии) необходимо проведение хирургической гистероскопии, при подозрении на эндометриоз, опухоли яичников - хирургической лапароскопии.